
【题目】丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图。

(1)丁子香酚分子式为______________。
(2)下列物质在一定条件下能跟丁子香酚反应的是___________。
a.NaOH溶液 b.NaHCO3溶液 c.FeCl3溶液 d.Br2的CCl4溶液
(3)符合下述条件的丁子香酚的同分异构体共有____________种,写出其中任意任一种结构简式___________。
①与NaHCO3溶液反应
②苯环上只有两个取代基
③苯环上的一氯取代物只有两种
(4)丁子香酚的某种同分异构体A可发生如下转化(部分反应条件已略去)。
提示:RCH=CHR′![]() RCHO+R′CHO
RCHO+R′CHO
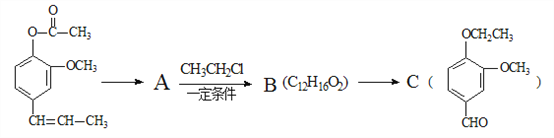
A→B的化学方程式为_______________________,C中滴加少量溴水振荡,主要现象为________________。
【答案】 C10H12O2 a、c、d 5 任写一种 
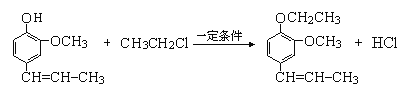 溴水褪色
溴水褪色
【解析】(1)由结构简式可知分子式为C10H12O2;
(2)丁子香酚含有碳碳双键、醚键、酚羟基和苯环,具有酚、醚、烯烃和苯的性质,能发生氧化反应、加成反应、还原反应、加聚反应、取代反应等;a.含有酚羟基,所以能与NaOH溶液发生中和反应,故正确;b.不含羧基,所以不能与NaHCO3溶液反应,故错误;c.含有酚羟基,所以能与FeCl3溶液发生显色反应,故正确;d.含有碳碳双键和酚羟基,所以能与Br2发生加成反应、取代反应,故正确;故选acd;
(3)与NaHCO3溶液反应,可分子中应含有-COOH,苯环上的一氯取代物只有两种,说明两个取代基应位于对位位置,则对应的同分异构体有 ;
;
(4)A是丁子香酚的同分异构体,则生成A的反应是水解反应,A的结构简式为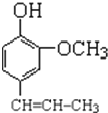 ,A和氯乙烷反应生成B,根据AB分子式知,A发生取代反应生成B,结合题给信息知,B中碳碳双键被氧化生成醛基,则B结构简式为
,A和氯乙烷反应生成B,根据AB分子式知,A发生取代反应生成B,结合题给信息知,B中碳碳双键被氧化生成醛基,则B结构简式为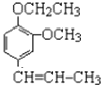 ,A的结构简式为
,A的结构简式为 、B结构简式为
、B结构简式为 ,A发生取代反应生成B,反应方程式为
,A发生取代反应生成B,反应方程式为 +CH3CH2Cl
+CH3CH2Cl![]()
 +HCl,C含有醛基,加入溴水,发生氧化还原反应,溴水褪色。
+HCl,C含有醛基,加入溴水,发生氧化还原反应,溴水褪色。


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】研究CO2、CO是处理方法对环境保护用重要意义。
(1)已知:①CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
②C(g)+2H2(g)![]() CH4(g) △H=-73kJ·mol-1
CH4(g) △H=-73kJ·mol-1
③2CO(g)![]() C(g)+CO2(g) △H=-171kJ·mol-1
C(g)+CO2(g) △H=-171kJ·mol-1
则CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=__________。
CH4(g)+2H2O(g) △H=__________。
(2)CO2与H2反应可合成甲醇:CO2(g)+3H2(g)![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)
某温度下,将1molCO2和3molH2充入探究不变的2L密闭容器中,发生上述反应。测得不同时刻的反应前后压强关系如下:
时间(h) | 1 | 2 | 3 | 4 | 5 | 6 |
P后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
①用CO2表示第1小时反应的平均速率v(CO2)=_______mol·L-1·h-1。
②该温度下的H2平衡转化率为______________。
(3)CO2与NH3反应可合成尿素:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
在T1℃时,将1molCO2和2molNH3置于1L密闭容器中,发生上述反应,在t时刻,测得容器中CO2转化率约为73%。保护其他初始实验条件不变,分别在温度为T2℃、T3℃、T4℃、T5℃时,重复上述实验,经过相同时间测得CO2转化率并绘制变化曲线如图所示:

①该反应的△H______0(填“>”或“<”)
②T4℃时该反应的平衡常数K=___________。
③在T1℃~T3℃之间,CO2转化率逐渐增大,其原因是____________________。
(4)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示
img src="http://thumb.zyjl.cn/questionBank/Upload/2018/01/02/09/ce4caee6/SYS201801020935301407189654_ST/SYS201801020935301407189654_ST.003.png" width="212" height="154" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />
①阳极区产生CO2的原因是______________(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应Z(?)+W(?)![]() X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
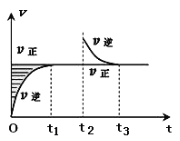
A.Z和W在该条件下至少有一个是为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C.若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
D.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4。某同学用15.0 g该废催化剂为原料,回收锌和铜。采用的实验方案如下,回答下列问题:

已知:ZnS与稀硫酸反应,且化合价不变; CuS既不溶解于稀硫酸,也不与稀硫酸反应
(1)在下列装置中,第一次浸出反应装置最合理的_______(填标号)。

(2)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法如下:____________。
(提供的试剂:稀盐酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水)
(3)本实验要用到抽滤,设所用的洗涤剂为X,抽滤洗涤沉淀的操作__________。
(4)写出第二次浸出的化学反应方程式__________________________,
向盛有滤渣1的反应器中加H2SO4和H2O2溶液,应先加_________________。
(5)滤渣2的主要成分是____________________________________。
浓缩、结晶得到硫酸锌晶体的主要仪器名称是______________________。
(6)某同学在实验完成之后,得到1.50 g CuSO4·5H2O,则铜的回收率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去CuCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再向滤液中加入适量盐酸。这种试剂是
A. 稀氨水 B. NaOH溶液 C. 硫氰化钾溶液 D. Cu(OH)2CO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,正确的是( )
A. 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应
B. 油脂、乙醇是人体必需的营养物质
C. 乙酸和乙酸乙酯均能使NaOH的酚酞溶液褪色,因为它们的分子组成和结构相同
D. 用饱和Na2CO3溶液可以除去乙酸乙酯中混有的少量乙酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,在木炭还原氧化铜的实验中发生的主要反应是C+2CuO![]() 2Cu+CO2↑。某化学实验小组对该实
2Cu+CO2↑。某化学实验小组对该实
验产物(假设已完全反应)进行了如下探究:
探究一:检验产物的成分
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体,那么该暗红色固体物质是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体,可以和硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O。
【猜想假设】暗红色固体除铜外还可能含有Cu2O。
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到_______________,说明猜想正确。
探究二:测定产物中Cu2O的含量

【查阅资料】草酸在浓硫酸的作用下会分解为CO和CO2
【设计实验】称取固体样品6.0g,置于上右图装置D中进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置E的质量达到实验目的。
(1)证明草酸的分解产物中有CO2存在的是_______________。
(2)装置C的作用是__________________。
(3)写出装置D中反应的化学方程式___________________________。
(4)下列为加热装置前所涉及的部分操作,正确的顺序是_________(填序号)。
①检查装置的气密性 ②关闭K2,打开K1,使装置A中的反应先进行一段时间
③连接仪器 ④关闭K1,打开K2
(5)若装置E在反应前后的质量分别为30.1g和31.2g,则该固体样品中Cu2O的质量分数为__________。
指出该装置的不足之处,说明不足的理由并绐出改进方案__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物在工农业生产、生活中有着重要的作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·molˉ1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
同一条件下,若2molCH4 还原NO2 至N2,生成气态水和二氧化碳。整个过程中放出的热量为1734kJ,则ΔH2=__________;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s)+3CH4(g)![]() 2Fe(s)+3CO(g)+6H2(g) ΔH>0。
2Fe(s)+3CO(g)+6H2(g) ΔH>0。
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为_______。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是_____(填序号)。
A.CH4的转化率等于CO的产率
B.混合气体的密度保持不变
C.速率:2v(CO)=v(H2)
D.固体的总质量保持不变
③该反应达到平衡时某物理量随温度变化如图所示,当压强由P1升高到P2时,平衡常数KA___KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些______。(填序号)

A.H2的逆反应速率
B.CH4的的转化率
C.混合气体的平均相对分子质量
D.CO的体积分数
(3)甲酸是易溶于水的一元弱酸。
①常温下,将1L 0.1mol/L HCOOH溶液与1L0.1mol/LNaOH溶液混合后,下列关系不正确的是____(填序号)。
a.c(H+)水·c(OH-)水=1×10-14 b.2c(H+)+c(HCOOH)=2c(OH-)+c(HCOO-)
c.c(Na+)=c(HCOOH)+c(HCOO-) d.c(HCOO-)>c(Na+)>c(H+)>c(OH-)
②向1L 0.1mol/L HCOONa溶液中加水稀释后,c(HCOOH)/c(HCOO-)的数值______(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com