
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4。某同学用15.0 g该废催化剂为原料,回收锌和铜。采用的实验方案如下,回答下列问题:

已知:ZnS与稀硫酸反应,且化合价不变; CuS既不溶解于稀硫酸,也不与稀硫酸反应
(1)在下列装置中,第一次浸出反应装置最合理的_______(填标号)。

(2)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法如下:____________。
(提供的试剂:稀盐酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水)
(3)本实验要用到抽滤,设所用的洗涤剂为X,抽滤洗涤沉淀的操作__________。
(4)写出第二次浸出的化学反应方程式__________________________,
向盛有滤渣1的反应器中加H2SO4和H2O2溶液,应先加_________________。
(5)滤渣2的主要成分是____________________________________。
浓缩、结晶得到硫酸锌晶体的主要仪器名称是______________________。
(6)某同学在实验完成之后,得到1.50 g CuSO4·5H2O,则铜的回收率为_____。
【答案】 D 取少量滤液1,滴加高锰酸钾溶液,若褪色,则证明有亚铁离子 关小水龙头,使洗涤剂X缓缓通过沉淀物 CuS+H2O2+H2SO4=CuSO4+S+2H2O H2SO4 SiO2、S 蒸发皿 30% .
【解析】(1)第一次浸出主要是ZnS和稀硫酸反应,ZnS和稀硫酸反应生成ZnSO4和H2S,硫化氢有毒,污染环境,所以必须要有尾气处理装置,合适的装置是D;(2)检验滤液1中的Fe2+,根据提供的试剂,为了操作简便可以选用高锰酸钾溶液,第一次浸出时加了稀硫酸,所以不需要再加酸,答案为:取少量滤液1,滴加高锰酸钾溶液,若褪色,则证明有Fe2+;(3)抽滤洗涤沉淀的操作是:关小水龙头,使洗涤剂x缓缓通过沉淀物;(4)第二次浸出主要是CuS在酸性条件下和H2O2发生的氧化还原反应,反应的化学方程式为CuS+ H2O2+H2SO4= CuSO4 +S+ 2H2O,向盛有滤渣1的容器中加H2SO4和H2O2,由于滤渣的主要成分是SiO2和CuS,可以催化过氧化氢分解,所以要先加入H2SO4;(5)二氧化硅不会和硫酸及过氧化氢反应,所以滤渣2的主要成分是SiO2,浓缩、结晶得到硫酸锌晶体的仪器是蒸发皿;(6)废催化剂中铜的物质的量为![]() =0.02mol,1.50 g CuSO4·5H2O晶体中铜的物质的量为:
=0.02mol,1.50 g CuSO4·5H2O晶体中铜的物质的量为: ![]() =0.006mol,则铜的回收率为
=0.006mol,则铜的回收率为![]() ×100%=30%。
×100%=30%。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3)
B. 向醋酸溶液中加水,醋酸的电离程度增大,  增大
增大
C. 向氨水中滴加盐酸时,离子浓度大小可能是:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
D. 若NaHA溶液中的pH=7,则H2A是弱酸;若NaHA溶液中的pH<7,则H2A是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、环境密切相关,下列说法错误的是
A. 补铁剂与维生素C共同服用可提高补铁效果
B. 铁粉和碳粉的混合物可作食品抗氧化剂
C. 生活中钢铁制品生锈主要是析氢腐蚀所致
D. 新能源汽车的推广使用有助于减少光化学烟雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是______(填字母序号)。
a. Fe b. FeO c. Fe3O4 d. Fe2O3
(2) 现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。 整个过程与温度密切相关, 当温度低于 570℃时,反应Fe3O4(s)+4 CO(g)![]() 3Fe(s)+4 CO2(g),阻碍循环反应的进行。
3Fe(s)+4 CO2(g),阻碍循环反应的进行。

① 已知:Fe3O4(s) + CO(g) ![]() 3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) + H2O(g)![]() Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
C(s)+CO2![]() 2CO(g) ΔH3 =+172.4 kJ·mol-1 。
2CO(g) ΔH3 =+172.4 kJ·mol-1 。
铁氧化物循环裂解水制氢气总反应的热化学方程式是_________。
② 下图表示其他条件一定时, Fe3O4(s)和 CO(g)反应达平衡时 CO(g)的体积百分含量随温度的变化关系。

i. 当温度低于570℃时,温度降低CO的转化率____(填“增大”、“减小”或“不变”),理由是______。
ii. 当温度高于570℃时,随温度升高,反应 Fe3O4(s) + CO(g) ![]() 3FeO(s) + CO2(g)平衡常数的变化趋势是________;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________。
3FeO(s) + CO2(g)平衡常数的变化趋势是________;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________。
(3)① 古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应 ii 的离子方程式是_______________。
② 如今基于普鲁士蓝合成原理可检测食品中 CN-,方案如下:
![]()
若试纸变蓝则证明食品中含有 CN-,请解释检测时试纸变蓝的原因_________。
(4)已知25℃时,Kap[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配置100mL 5mol/LFeCl3溶液,为使配置过程中不出现浑浊现象,则至少需要加入2mol/L的盐酸_________mL(忽略加入盐酸体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答:

(1)周期表中第三周期第IIA族的元素是__________;
(2)P、S、Cl三种元素中,非金属性最强的是________(填元素符号);
(3)钠元素最高价氧化物对应的水化物化学式是________,常温下该水化物溶液的pH____7(填“>”或“<”或“=”);
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____反应(填“放热”或“吸热”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图。

(1)丁子香酚分子式为______________。
(2)下列物质在一定条件下能跟丁子香酚反应的是___________。
a.NaOH溶液 b.NaHCO3溶液 c.FeCl3溶液 d.Br2的CCl4溶液
(3)符合下述条件的丁子香酚的同分异构体共有____________种,写出其中任意任一种结构简式___________。
①与NaHCO3溶液反应
②苯环上只有两个取代基
③苯环上的一氯取代物只有两种
(4)丁子香酚的某种同分异构体A可发生如下转化(部分反应条件已略去)。
提示:RCH=CHR′![]() RCHO+R′CHO
RCHO+R′CHO
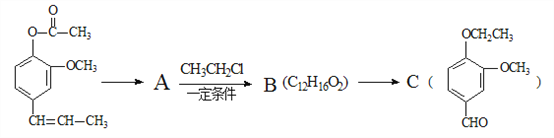
A→B的化学方程式为_______________________,C中滴加少量溴水振荡,主要现象为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;丫与M形成的气态化合物在标准状况下的密度为0.76g·L-1; W的质子数是X、Y、Z、M四种元素质子数之和的![]() ,下列说法正确的是
,下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. YZ2溶于水形成的溶液具有较强的氧化性
C. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
D. 1 molWM溶于足量水中完全反应共转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种常用的学习用品——圆规的材料组成:

(1)圆规含有的金属单质是___________(填化学式),请写出它在氧气中燃烧的化学方程式____________。
(2)这些材料中属于有机合成材料的是_________(填序号)。
(3)铅笔芯的主要成分是_________,请写出它的另一种用途_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com