
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是______(填字母序号)。
a. Fe b. FeO c. Fe3O4 d. Fe2O3
(2) 现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。 整个过程与温度密切相关, 当温度低于 570℃时,反应Fe3O4(s)+4 CO(g)![]() 3Fe(s)+4 CO2(g),阻碍循环反应的进行。
3Fe(s)+4 CO2(g),阻碍循环反应的进行。

① 已知:Fe3O4(s) + CO(g) ![]() 3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) + H2O(g)![]() Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
C(s)+CO2![]() 2CO(g) ΔH3 =+172.4 kJ·mol-1 。
2CO(g) ΔH3 =+172.4 kJ·mol-1 。
铁氧化物循环裂解水制氢气总反应的热化学方程式是_________。
② 下图表示其他条件一定时, Fe3O4(s)和 CO(g)反应达平衡时 CO(g)的体积百分含量随温度的变化关系。

i. 当温度低于570℃时,温度降低CO的转化率____(填“增大”、“减小”或“不变”),理由是______。
ii. 当温度高于570℃时,随温度升高,反应 Fe3O4(s) + CO(g) ![]() 3FeO(s) + CO2(g)平衡常数的变化趋势是________;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________。
3FeO(s) + CO2(g)平衡常数的变化趋势是________;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________。
(3)① 古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应 ii 的离子方程式是_______________。
② 如今基于普鲁士蓝合成原理可检测食品中 CN-,方案如下:
![]()
若试纸变蓝则证明食品中含有 CN-,请解释检测时试纸变蓝的原因_________。
(4)已知25℃时,Kap[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配置100mL 5mol/LFeCl3溶液,为使配置过程中不出现浑浊现象,则至少需要加入2mol/L的盐酸_________mL(忽略加入盐酸体积)。
【答案】cC(s) + H2O(g) =H2(g) + CO(g) ΔH = + 134.5 kJ· mol-1增大理由:当温度低于570℃时,温度降低,CO的体积百分含量降低,可逆反应Fe3O4+4CO(g)![]() 3Fe(s)+4CO2(g) 正向移动,故CO的转化率增大增大43[Fe(CN)6]4- + 4Fe3+ =Fe4[Fe(CN)6]3↓碱性条件下,Fe2+与 CN-结合生成[Fe(CN)6]4- ,Fe2+被空气中 O2 氧化生成 Fe3+ ,[Fe(CN)6]4- 与 Fe3+反应生成普鲁士蓝使试纸显蓝色2.5
3Fe(s)+4CO2(g) 正向移动,故CO的转化率增大增大43[Fe(CN)6]4- + 4Fe3+ =Fe4[Fe(CN)6]3↓碱性条件下,Fe2+与 CN-结合生成[Fe(CN)6]4- ,Fe2+被空气中 O2 氧化生成 Fe3+ ,[Fe(CN)6]4- 与 Fe3+反应生成普鲁士蓝使试纸显蓝色2.5
【解析】(1)古代中国四大发明之一的司南是由天然磁石制成的,磁铁成分主要是四氧化三铁,选c;
(2)①Ⅰ.Fe3O4(s)+CO(g)3FeO(s)+CO2(g)△H1═+19.3kJmol-1
Ⅱ.3FeO(s)+H2O(g)Fe3O4(s)+H2(g)△H2═-57.2kJmol-1
Ⅲ.C(s)+CO2(g)2CO(g)△H3═+172.4kJmol-1
依据盖斯定律计算Ⅰ+Ⅱ+Ⅲ得到铁氧化物循环裂解水制氢气总反应的热化学方程式;C(s)+H2O(g)═H2(g)+CO(g)△H═+134.5kJmol-1 ;
②i. 当温度低于570℃时,温度降低CO的转化率增大;因为当温度低于570℃时,温度降低,CO的体积百分含量降低,可逆反应Fe3O4+4CO(g)![]() 3Fe(s)+4CO2(g) 正向移动,故CO的转化率增大。
3Fe(s)+4CO2(g) 正向移动,故CO的转化率增大。
ii.高于570°C,随温度升高,反应Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g)平衡正向进行,平衡常数的变化趋势增大,1040℃时CO体积分数为20%,结合三行计算列式计算得到平衡浓度,设起始浓度CO为1mol/L,消耗CO浓度为x
3FeO(s)+CO2(g)平衡正向进行,平衡常数的变化趋势增大,1040℃时CO体积分数为20%,结合三行计算列式计算得到平衡浓度,设起始浓度CO为1mol/L,消耗CO浓度为x
Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g)
3FeO(s)+CO2(g)
起始量(mol/L) 1 0
变化量(mol/L) xx
平衡量(mol/L) 1-x x![]() =20%,x=0.8mol/L,K=
=20%,x=0.8mol/L,K=![]() =4;
=4;
(3)①[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀,反应的离子方程式为:3[Fe(CN)6]4-+4Fe3+═Fe4[Fe(CN)6]3↓;
②基于普鲁士蓝合成原理可检测食品中CN-,碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4-与Fe3+反应生成普鲁士蓝使试纸显蓝色。
(4)若不出现浑浊现象,则c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],代入有关数据后可求出c(OH-)≤2×10-13mol/L,c(H+)≥0.05mol/L,则加入盐酸的体积至少为![]() =0.0025L=2.5mL。
=0.0025L=2.5mL。


科目:高中化学 来源: 题型:
【题目】据报道,N5是破坏力极强的炸药之一,18O2是比黄金还贵的物质。下列说法正确的是( )
A. N5和N2互为同位素 B. 2N5==5N2是化学变化
C. 原子半径:N<18O D. 18O2的摩尔质量为36
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应Z(?)+W(?)![]() X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
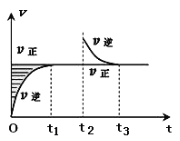
A.Z和W在该条件下至少有一个是为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C.若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
D.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铃兰醛具有甜润的香味,常用作肥料、洗涤剂和化妆品的香料。合成铃兰醛的路线如图所示(部分试剂和条件未注明):



请回答下列问题:
(1)A的系统命名为:__________________;B→D的反应类型:_______________
(2)A→B的化学方程式是___________________________________________;
(3)H→铃兰醛的化学方程式是___________________________________________;
(4)下列有关G的叙述中,不正确的是______(填序号)。
A.G分子中有6种不同化学环境的氢原子
B.G能发生消去反应、氧化反应和还原反应
C.1molG最多能与5molH2发生加成反应
D.G能使溴水褪色
(5)H的同分异构体有多种,试写出满足以下条件的一种结构简式:__________。
①遇FeCl3溶液呈紫色,②核磁共振氢谱中有四种类型氢原子的吸收峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4。某同学用15.0 g该废催化剂为原料,回收锌和铜。采用的实验方案如下,回答下列问题:

已知:ZnS与稀硫酸反应,且化合价不变; CuS既不溶解于稀硫酸,也不与稀硫酸反应
(1)在下列装置中,第一次浸出反应装置最合理的_______(填标号)。

(2)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法如下:____________。
(提供的试剂:稀盐酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水)
(3)本实验要用到抽滤,设所用的洗涤剂为X,抽滤洗涤沉淀的操作__________。
(4)写出第二次浸出的化学反应方程式__________________________,
向盛有滤渣1的反应器中加H2SO4和H2O2溶液,应先加_________________。
(5)滤渣2的主要成分是____________________________________。
浓缩、结晶得到硫酸锌晶体的主要仪器名称是______________________。
(6)某同学在实验完成之后,得到1.50 g CuSO4·5H2O,则铜的回收率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断A(g)+B(g) ![]() C(g)+D(g)是否达到平衡的依据为( )
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com