
【题目】向20mL 0.5mol/L的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示.下列关于混合溶液的相关说法错误的是( ) 
A.醋酸的电离平衡常数:b点>a点
B.由水电离出的c(OH):b点>c点
C.从a点到b点,混合溶液中可能存在:c(CH3COO﹣)=c(Na+)
D.b点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
【答案】D
【解析】解:A.醋酸是弱电解质,在水溶液里存在电离平衡,且其电离过程吸热,温度越高,醋酸的电离程度越大,其电离常数越大,故A正确;B.b点酸碱恰好反应生成醋酸钠,c点氢氧化钠过量,氢氧化钠抑制水电离,醋酸钠促进水电离,所以由水电离出的c(OH﹣):b点>c点,故B正确;
C.如果c(CH3COO﹣)=c(Na+),根据电荷守恒知,溶液中c(OH﹣)=c(H+),醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使其溶液呈中性,则醋酸应该稍微过量,所以从a点到b点,混合溶液中可能存在:c(CH3COO﹣)=c(Na+),故C正确;
D.从b点到c点,氢氧化钠过量,溶液中的溶质是醋酸钠和氢氧化钠,当氢氧化钠的物质的量大于醋酸钠的物质的量时,混合溶液中存在:c(Na+)>c(OH﹣)>c(CH3COO﹣)>c(H+),故D错误;
故选D.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】根据高中所学的化学反应原理解答下面的问题:
(1)下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0 kJmol﹣1
反应Ⅱ:2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)△H=﹣173.6kJmol﹣1
写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:
(2)工业合成甲醇的反应:CO(g)+2H2(g)CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
温度/℃ | 250 | 350 |
K | 2.041 | x |
符合表中的平衡常数x的数值是(填字母序号).
A.0 B.0.012
C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
c(CO) | c(H2) | c(CH3OH) | |
0min | 0.8molL﹣1 | 1.6molL﹣1 | 0 |
2min | 0.6molL﹣1 | y | 0.2molL﹣1 |
4min | 0.3molL﹣1 | 0.6molL﹣1 | 0.5molL﹣1 |
6min | 0.3molL﹣1 | 0.6molL﹣1 | 0.5molL﹣1 |
反应从2min到4min之间,H2的平均反应速率为 . 反应达到平衡时CO的转化率为 . 反应在第2min时改变了反应条件,改变的条件可能是(填字母序号).
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.升高温度
(3)全钒液流储能电池(VRB)广泛应用于风能、太阳能发电系统的储能系统,电池反应为VO2++V2++2H+ ![]() VO2++V3++H2O,试推写出放电时正极的电极反应式 .
VO2++V3++H2O,试推写出放电时正极的电极反应式 .
(4)如图2为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:该温度下,溶度积常数的关系为:Ksp[Fe(OH)3] Ksp[Mg(OH)2](填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+ , 振荡后,白色沉淀会全部转化为红褐色沉淀,原因是 . 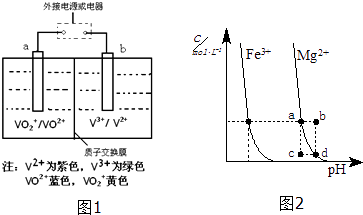
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W,R的化合价与原子序数的关系如图所示.下列说法正确的是( ) 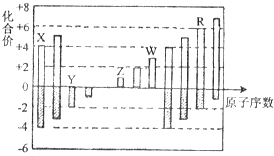
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:Y<R
C.Z和Y形成的化合物是离子化合物
D.常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡(NO2浓度约为0.0125molL﹣1).如图中的曲线表示二氧化氮分解反应在前25s内的反应进程. 
(1)写出反应的化学方程式 .
(2)在10s内氧气的反应速率 .
(3)若反应延续至70s,请在图中用实线画出25s至70s的反应进程曲线;
(4)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加催化剂的反应进程曲线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解池的叙述中不正确的是( )
A.与电源正极相连的是电解池的阴极
B.与电源负极相连的是电解池的阴极
C.在电解池的阳极发生氧化反应
D.电子从电源的负极沿导线流入电解池的阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙固体是登山运动员常用的能源提供剂.某兴趣小组拟选用如下装置制备氢化钙. 
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为(填仪器接口的字母编号);
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;(请按正确的顺序填入下列步骤的标号);
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成. ①写出CaH2与水反应的化学方程式;
②该同学的判断不正确,原因是(用相关化学方程式表示) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法不正确的是( )
A.聚氯乙烯分子中含碳碳双键
B.以淀粉为原料可制取乙酸乙酯
C.戊烷有3种同分异构体
D.油脂的皂化反应属于水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com