
【题目】二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡(NO2浓度约为0.0125molL﹣1).如图中的曲线表示二氧化氮分解反应在前25s内的反应进程. 
(1)写出反应的化学方程式 .
(2)在10s内氧气的反应速率 .
(3)若反应延续至70s,请在图中用实线画出25s至70s的反应进程曲线;
(4)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加催化剂的反应进程曲线.
【答案】
(1)2NO2?2NO+O2
(2)7.5×10﹣4mol/(L?s)
(3)
(4)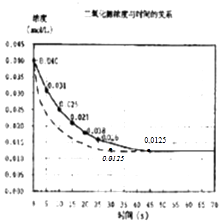
【解析】解:(1)二氧化氮在加热条件下能够分解成一氧化氮和氧气,达到平衡时NO2浓度约为0.0125molL﹣1 , 说明为可逆反应,反应方程式为:2NO22NO+O2 , 所以答案是:2NO22NO+O2;(2)由图可知,10秒内NO2的浓度变化为0.04mol/L﹣0.015mol/L=0.025mol/L,故v(NO2)= ![]() =0.0015mol/(Ls),对于2NO22NO+O2 , 速率之比等于化学计量数之比,所以v(O2)=
=0.0015mol/(Ls),对于2NO22NO+O2 , 速率之比等于化学计量数之比,所以v(O2)= ![]() v(NO2)=
v(NO2)= ![]() ×0.0015mol/(Ls)=7.5×10﹣4mol/(Ls),所以答案是:7.5×10﹣4mol/(Ls);(3)25s后二氧化氮浓度继续减小,该反应进行到45秒时,达到平衡是NO2浓度约为0.0125mol/L,实线画出25秒至70秒的反应进程曲线为
×0.0015mol/(Ls)=7.5×10﹣4mol/(Ls),所以答案是:7.5×10﹣4mol/(Ls);(3)25s后二氧化氮浓度继续减小,该反应进行到45秒时,达到平衡是NO2浓度约为0.0125mol/L,实线画出25秒至70秒的反应进程曲线为  ,所以答案是:
,所以答案是:  ; 3)若在反应开始时加入催化剂(其他条件都不变),反应速率加快,相同时间内NO2浓度变化量增大,到达平衡时间缩短,但不影响平衡移动,达到平衡是NO2浓度约为0.0125mol/L,用虚线画出加催化剂后的反应进程曲线为
; 3)若在反应开始时加入催化剂(其他条件都不变),反应速率加快,相同时间内NO2浓度变化量增大,到达平衡时间缩短,但不影响平衡移动,达到平衡是NO2浓度约为0.0125mol/L,用虚线画出加催化剂后的反应进程曲线为 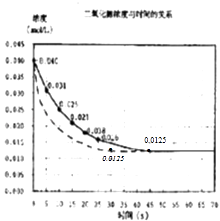 ,所以答案是:
,所以答案是:  .
.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答: 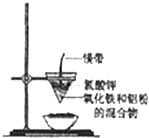
(1)氧化铁与铝反应的化学方程式是 ,
(2)镁带的作用是;氯酸钾的作用是 .
(3)同学们在实验过程中观察到纸漏斗的下部被烧穿,有熔融物落入沙中.他们为探究此熔融物的成分,查阅(化学手册)得知有关物质的熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | ﹣ |
同学们分析数据后推测该熔融物是一种合金,其中的金属是 , 溶解该合金可选用下列试剂中的(填序号).
A.FeSO4溶液 B.稀硫酸 C.稀硝酸 D.NaOH溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应过程中能量变化的说法正确的是( )
A.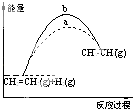 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
B.己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2 . 则△H1>△H2
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D.在一定条件下,某可逆反应的△H=+100kJmol﹣1 , 则该反应正反应活化能比逆反应活化能大100kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.电负性的大小顺序为Cl>S>P
B.由于NO3﹣和SO3互为等电子体,所以可以推断NO3﹣的空间构型为平面三角形
C.根据晶格能的大小可以判断MgCl2的熔点比CaCl2高
D.液态HF的沸点比液态HCl的沸点高是因为氢氟键的键能比氢氯键的键能大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】15 g A物质和10.5 g B物质恰好完全反应,生成7.2 g C物质,1.8 gD物质和0.3 mol E物质,则E物质的摩尔质量是
A. 16.5 g/mol B. 111 g/mol C. 55 g/mol D. 27.5 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与生产生活关系密切。请完成下列填空:
(1)某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

①装置甲中盛放浓硝酸的仪器A的名称是__________________, 装置丙中的试管内发生反应的离子方程式为:______________________________。
②实验过程中装置乙、丙中出现的现象分别是________________________;______________。
(2)NO在医疗上有重要的应用,曾被科学家作为研究的重要物质。现有容积为aL的试管盛满NO后倒扣于水槽中,再向试管中通入一定体积O2后,试管内气体的体积为试管容积的一半,则通入的O2的在相同条件下体积为____________。
A.0.75aL B.0.375aL C.0.625aL D.1.25aL
(3)在盛有一定量浓硝酸的试管中加入12.8g的铜片发生反应。请回答下列问题:
①开始阶段,反应的化学方程式为_______________________________,后一阶段生成的气体为
_______,若两者恰好完全反应整个反应过程共产生标准状况下气体2.24L,则反应过程中被还原的HNO3的物质的量为__________ mol.,参加反应的HNO3的物质的量为__________ mol.。
②反应结束后往试管中加入铜片,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL 0.5mol/L的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示.下列关于混合溶液的相关说法错误的是( ) 
A.醋酸的电离平衡常数:b点>a点
B.由水电离出的c(OH):b点>c点
C.从a点到b点,混合溶液中可能存在:c(CH3COO﹣)=c(Na+)
D.b点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下: 
(1)气体A中的大气污染物可选用下列试剂中的吸收. a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在(填离子符号),检验溶液中还存在Fe2+的方法是(注明试剂、现象).
(3)由泡铜冶炼粗铜的化学反应方程式为 .
(4)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4 , 若将该反应设计为原电池,其正极电极反应式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com