
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图1所示(图中有些反应的生成物和反应的条件没有标出).
请回答下列问题:
(1)写出下列物质的化学式:B、丙、乙 .
(2)写出下列反应的离子方程式:
反应①;
反应⑤;
反应⑥ .
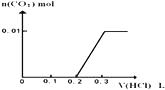
(3)将0.4g D和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1molL﹣1稀盐酸.在如图2所示的坐标系中画出能正确表示加入盐酸的体积和生成CO2的物质的量的关系图象 .
(4)将18.4 g D 和NaHCO3固体混合物,在密闭容器中加热到约250℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6 g。试计算混合物中NaOH的质量分数。(请写出计算过程)
【答案】
(1)Al;HCl;Cl2
(2)2Na+2H2O=2Na++2OH﹣+H2↑;Cl2+2Fe2+=2Fe3++2Cl﹣;Fe3++3OH﹣=Fe(OH)3↓
(3)
(4)解:若设NaOH和NaHCO3按1∶1反应:
NaHCO3+ | NaOH | m |
84 | 40 | 18 |
8.4g | 4.0g | 18.4 g-16.6 g=1.8 g |
8.4 g+4.0 g=12.4 g<18.4 g,说明反应不是按上述比率进行反应。
若NaHCO3过量,由于受热会发生分解,其差值还会增大。与题意不合。
若NaOH过量,由于受热不会分解,不影响其差值,符合题意。
过量的NaOH质量为18.4 g-8.4g-4g=6.0g
m(NaOH)=4.0 g+6.0g=10.0g
NaOH的质量分数= ![]() ×100%=54.3%。
×100%=54.3%。
【解析】金属单质A的焰色反应为黄色,应为Na,与水反应生成的气体甲为H2 , D为NaOH,黄绿色气体乙为Cl2 , 则丙为HCl,E为盐酸,能与NaOH反应生成氢气的B为Al,红褐色沉淀H为Fe(OH)3 , 则C为Fe,F为FeCl2 ,G为FeCl3 , (1)由以上分析可知B为Al,丙为HCl,乙为Cl2。(2)根据上述分析,反应①为Na与水的反应,反应的离子方程2Na+2H2O=2Na++2OH﹣+H2↑;反应⑤是氯气与FeCl2反应生成FeCl3 ,反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl﹣;反应⑥是NaOH与FeCl3反应生成Fe(OH)3红褐色沉淀,则反应的离子方程式为Fe3++3OH﹣=Fe(OH)3↓。(3)0.4g NaOH的物质的量为0.4g÷40g/mol=0.01mol,1.06g Na2CO3的物质的量为0.01mol,两者混合并配成溶液,向溶液中滴加0.1molL﹣1稀盐酸,首先发生NaOH+HCl=NaCl+H2O、消耗HCl0.01mol,然后发生Na2CO3+HCl=NaHCO3+HCl,消耗HCl0.01mol,最后发生NaHCO3+HCl=NaCl+CO2↑+H2O,消耗HCl0.01mol,据上述数据,画出盐酸的体积和生成CO2的物质的量的关系图象为  。(4)若设NaOH和NaHCO3按1∶1反应:
。(4)若设NaOH和NaHCO3按1∶1反应:
NaHCO3+ | NaOH | m |
84 | 40 | 18 |
8.4g | 4.0g | 18.4 g-16.6 g=1.8 g |
8.4 g+4.0 g=12.4 g<18.4 g,说明反应不是按上述比率进行反应。
若NaHCO3过量,由于受热会发生分解,其差值还会增大。与题意不合。
若NaOH过量,由于受热不会分解,不影响其差值,符合题意。
过量的NaOH质量为18.4 g-8.4g-4g=6.0g
m(NaOH)=4.0 g+6.0g=10.0g
NaOH的质量分数= ![]() ×100%=54.3%。
×100%=54.3%。
第一步推断物质:推断题解题最重要的1、寻找题眼(突破口):根据题目条件可直接判断某物质或某反应
2、依据元素守恒原则,可通过反应物(或生成物)所含元素推测生成物可能含有的元素(或反应物),再根据常见反应或某些特殊条件(如该物质的摩尔质量)推测、确定物质的化学式。
本题最明显的突破口是:1、金属A为Na(金属、焰色为黄色)2、乙为Cl2(黄绿色气体)3、H为Fe(OH)3(红褐色沉淀)
间接判断:4、A金属钠与水生成氢气和氢氧化钠,则气体甲为氢气,物质D为NaOH;5、甲(H2)与乙(Cl2)生成气体丙(HCl),则E为盐酸;6金属B与物质D(NaOH)反应生成气体甲(H2),则金属B为铝;7由反应④⑤⑥(乙为Cl2、E为盐酸、H为Fe(OH)3、D为NaOH)判断出金属C为铁,物质F为氯化亚铁(FeCl2),物资G为氯化铁(FeCl3)
第二步:按要求解题
(1)B为Al,丙为HCl,乙为Cl2
(2)①为Na与水:2Na+2H2O=2Na++2OH﹣+H2↑
⑤是气与FeCl2:Cl2+2Fe2+=2Fe3++2Cl﹣
⑥NaOH与FeCl3:Fe3++3OH=Fe(OH)3↓
(3)本题关键考虑反应的先后顺序:0.4g D(NaOH)和1.06g Na2CO3(即0.01molNaOH,0.01moNa2CO3)混合,与盐酸反应顺序:
1、氢氧化钠与盐酸中和,消耗盐酸0.01mol,不产生气体
2、碳酸钠与盐酸反应,由于一开始碳酸钠过量,盐酸少量,所以反应要分2步进行:Na2CO3HCl→NaHCO3HCl→CO2↑
Na2CO3+HCl=NaHCO3+HCl,需再次消耗盐酸0.01mol,无气体生成
NaHCO3+HCl=NaCl+CO2↑+H2O,再次消耗HCl0.01mol,产生0.01molCO2↑
再加盐酸,不再反应。
(4)写出可能反应:2NaHCO3 =Na2CO3+H2O+CO2↑;
NaCO3+ | NaOH =Na2CO3+H2O |
分析:NaOH的物质的量大于NaHCO3的物质的量时,剩余固体为氢氧化钠和碳酸钠混合物,NaOH的物质的量小于等于NaHCO3的物质的量时,剩余固体为碳酸钠。所以本题需采用极值法分析。
1、NaOH的物质的量等于NaHCO3的物质的量时:剩余固体为碳酸钠:
NaHCO3+ | NaOH = Na2CO3+H2O | |
84 | 40 差值=18 | |
固体质量差=18.4-16.6=1.8g |
可以求出反应的NaHCO3的质量为8.4g,反应的NaOH的质量为4g
则8.4 g+4.0 g=12.4 g,说明有反应物剩余18.4-12.4=6g
2、NaOH的物质的量小于NaHCO3的物质的量时:(若碳酸氢钠剩余6g,继续分解造成质量差值大于1.8g,与题意不符)
3、NaOH的物质的量大于NaHCO3的物质的量时:(若氢氧化钠剩余6g,不反应,质量不再变化,满足题目要求)
则原固体含NaOH质量为4+6=10g,再求其质量分数即可。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】提纯含有少量泥沙的粗盐,下列操作顺序正确的是( )
A. 过滤、蒸发、结晶、溶解
B. 溶解、蒸发、过滤、结晶
C. 溶解、蒸发、结晶、过滤
D. 溶解、过滤、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置除去含CN﹣、Cl﹣废水中的CN﹣时,控制溶液pH为9~10,某电极上产生的ClO﹣将CN﹣氧化为两种无污染的气体,下列说法正确的是( ) 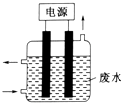
A.可以用石墨作阳极,作铁阴极
B.除去CN﹣的反应:2CN﹣+5ClO﹣+2H+═N2↑+2CO2↑+5Cl﹣+H2O
C.阴极的电极反应式为:Cl﹣+2OH﹣+2e﹣═ClO﹣+H2O
D.阳极的电极反应式为:2CN﹣+12OH﹣﹣10e﹣═N2↑+2CO32﹣+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理、方法和结论都正确的是( )
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.向某无色溶液中加入稀盐酸无现象,再加入BaCl2溶液产生白色沉淀,证明含SO42ˉ
D.已知I3﹣![]() I2+I﹣ , 向盛有KI3溶液的试管中加入适量CCl4 , 振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I﹣ , 向盛有KI3溶液的试管中加入适量CCl4 , 振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金晶体是面心立方体,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为Acm,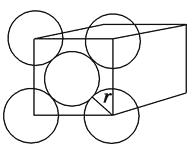
求:
(1)金晶体中最小的一个立方体含有个金原子。
(2)金的密度为g·cm-3。(用带A计算式表示)
(3)金原子空间占有率为。(Au的相对原子质量为197,用带A计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题: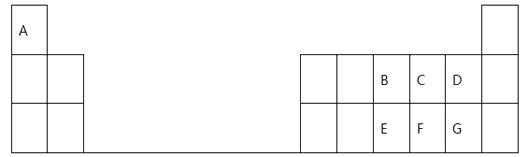
(1)画出C的原子结构示意图:。
(2)E在元素周期表中的位置是。
(3)B、C、D、F四种元素所形成的气态氢化物最稳定的是(填化学式)。
(4)E、F、G元素的最高价氧化物对应水化物的酸性最强的是(填化学式)。
(5)A、B、G三元素形成的化合物的电子式是 , 其中所含的化学键有哪些类型。
(6)B的最高价氧化物的水化物的稀溶液与金属铜反应的离子方程式为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com