
����Ŀ�����������е�18��Ԫ�ؾ�����Ҫ����;�����ִ���ҵ�б���������
��1������һ��Ӳ���࣬����ʴ��ǿ�Ľ����������ڵ�ƺ��������ָ֣���̬Crԭ���У�����ռ������ܲ�ķ���Ϊ___�����ܲ��Ͼ��е�ԭ�ӹ����Ϊ___��
��2����������Ԫ�صĵ�һ��������ԭ��������������������������ģ�30Zn��31Ga�ĵ�һ�������Ƿ������һ���ɣ�___����ǡ�����ԭ����______________�����ǰһ����ǡ������ʿ��Բ��𣩡�
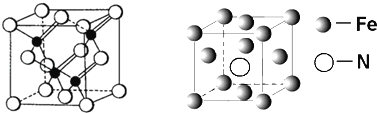
��3�������VA��Ԫ�ؿ��γɶ��������˹��뵼����ϣ��黯�أ�GaAs����������һ�֣��侧��ṹ����ͼ��ʾ����ɫ�����Asԭ�ӣ�����GaAs�����У�ÿ��Gaԭ����____��Asԭ����������ͬһ��Gaԭ��������Asԭ�ӹ��ɵĿռ乹��Ϊ_____��
��4����Asͬ����Ķ�����Ԫ����N��P��AsH3����ԭ���ӻ�������Ϊ____��һ��ѹǿ�½�AsH3��NH3��PH3�Ļ�����彵��ʱ����Һ������_______��������__________��
��5�����Ķ��ֻ������Ϊ���Բ��ϣ�������������һ�֣�ij�������ľ����ṹ��ͼ��ʾ�������Ļ�ѧʽΪ________���辧���߳�Ϊacm�������ӵ�����ΪNA���þ�����ܶ�Ϊ__g��cm��3���ú�a��NA��ʽ�ӱ�ʾ��
���𰸡�N 16 �� 30Zn��4s�ܼ���2�����ӣ�����ȫ��״̬�����ȶ� 4 �������� sp3 NH3 NH3����֮����������е�ϸ� Fe4N ![]() ��
��
��������
���⣨1�����ݸ���������Ų���֪����Ԫ���������N�㣬�ݴ˻ش�(2)30Zn��4s�ܼ���2�����ӣ�����ȫ��״̬�����ȶ���31Ga��4p�ܼ���1�����ӣ����ȶ���(3)���� GaAs�ľ����ṹͼ��֪��Asλ�ھ��������ĺͶ�����Gaλ����4��Asԭ�ӹ��ɵ���������������ݴ��жϣ�(4)��Asͬ�����Ԫ����N��P������AsH3�ĽṹӦ��NH3������NH3����֮����������е������(5)���ݾ�̯��ȷ���������Ļ�ѧʽ������![]() �����ܶȡ�
�����ܶȡ�
��������1�����ĺ�������Ų���1s22s22p63s23p63d54s1��ԭ����������������ߣ���Ԫ���������N�㣬���ܲ��Ϲ���spdf�ĸ��ܼ������е�ԭ�ӹ����Ϊ1+3+5+7=16��
(2)30Zn��4s�ܼ���2�����ӣ�����ȫ��״̬�����ȶ���31Ga��4p�ܼ���1�����ӣ����ȶ�������30Zn��31Ga�ĵ�һ�����ܲ�������ԭ������������һ������������Ĺ��ɣ�
(3)���� GaAs�ľ����ṹͼ��֪��Asλ�ھ��������ĺͶ�����Gaλ����4��Asԭ�ӹ��ɵ��������������ÿ��Gaԭ����4��Asԭ����������ͬһ��Gaԭ��������Asԭ�ӹ��ɵĿռ乹��Ϊ�������壻
(4)NH3��Nԭ�ӵ��ӻ���ʽ��![]() ��N��P��Asͬ���壬����AsH3�ĽṹӦ��NH3������AsH3��As���ӻ���ʽ��
��N��P��Asͬ���壬����AsH3�ĽṹӦ��NH3������AsH3��As���ӻ���ʽ��![]() ��NH3����֮����������е������һ��ѹǿ�½�AsH3��NH3��PH3�Ļ�����彵��ʱ����Һ������NH3��(5)���ݾ�̯����Nԭ��λ�ھ������ģ�����1��Nԭ�ӣ�Feԭ��λ�ڶ�������ģ�Fe����
��NH3����֮����������е������һ��ѹǿ�½�AsH3��NH3��PH3�Ļ�����彵��ʱ����Һ������NH3��(5)���ݾ�̯����Nԭ��λ�ھ������ģ�����1��Nԭ�ӣ�Feԭ��λ�ڶ�������ģ�Fe����![]() �����Ե�������ѧʽ��Fe4N�������߳�Ϊacm��һ�����������Ϊ
�����Ե�������ѧʽ��Fe4N�������߳�Ϊacm��һ�����������Ϊ![]() ��һ��������������
��һ��������������![]() ������
������![]() ���þ�����ܶ�Ϊ
���þ�����ܶ�Ϊ![]() g��cm��3��
g��cm��3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʧȥ��ǩ��NaCl��FeCl2��FeCl3��MgCl2������Һ��ֻ��Ҫһ���Լ��Ϳ������Ǽ������������Լ��ǣ� ��
A.��ˮB.��������ҺC.Na2SO4��ҺD.KSCN��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С�������ð�����CuO��Ӧ,�о����������ʲ��������,���������ʵ�飨�г�װ��δ����������ʵ�顣��ش��������⣺
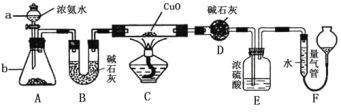
��1������a������Ϊ____________������b�п�ѡ����Լ�Ϊ��������һ�֣�_____________��
��2��ʵ���У�װ��C�к�ɫCuO��ĩȫ��ת��Ϊ��ɫ���壨��֪Cu2OҲΪ��ɫ���壩��������������ɫ��ζ�����塣ʵ��ǰ��ȡ��ɫCuO 80g��ʵ���õ���ɫ��������Ϊ68g�����ɫ����ɷֵĻ�ѧʽΪ_______________��
��3��Eװ����Ũ�����������____________________________________��
��4��F�ж�ȡ�������ǰ��Ӧ��װ��F���еIJ����ǣ�___________________�����˲�������F�����Һ������ұ�Һ�棬�ᵼ�¶�ȡ���������________ ���ƫ��ƫС������Ӱ�족����ͼ�������ܿ���________ ����ѡ����ĸ��գ�A����ʽ�ζ��ܣ�B����ʽ�ζ��ܣ���װ���ɡ�
��5��Ҫ���ð��������е�����ԭ�Ӹ����ȣ�ʵ����Ӧ���ٲ������ȡ��Щ����________��
A��Bװ��ʵ��ǰ��������mg�� B��Fװ��ʵ��ǰ��Һ���VL
C��Dװ��ʵ��ǰ��������mg�� D��Eװ��ʵ��ǰ��������mg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����

A. ��ͼ��֪�������¶ȴ����Ƶ�ˮ��̶�����
B. ��ͼ�ҿ�֪��a��Kw����ֵ��b��Kw����ֵ��
C. ��ͼ����֪����ӦA(g)+B(g) ![]() 2C(g)�����ȷ�Ӧ
2C(g)�����ȷ�Ӧ
D. ��ͼ����֪����ӦC(���ʯ��s)= C(ʯī��s)���ʱ���H=��H1����H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA�ǰ����ӵ�������ֵ������˵����ȷ����
A. ���³�ѹ�£�6.4g O2��O3�Ļ�������к��еķ�����Ϊ0.4 NA
B. ��״���£�2.24 L CCl4�����й��ۼ�����ĿΪ0.4NA
C. 25��ʱ��pH��13��Ba(OH)2��Һ�к���������������Ϊ0.1 NA
D. �����£�16.8 g Fe������ˮ������ȫ��Ӧʧȥ0.8NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ϡNa3AsO3��Һ��ϡ��ˮ��ϡNaOH��Һ��ϣ��������·�Ӧ��AsO33- (aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l) ����Ӧһ��ʱ�����c(AsO43-)Ϊa mol��L-1������˵�����жϷ�Ӧ�ﵽƽ��״̬����
AsO43-(aq)+2I-(aq)+H2O(l) ����Ӧһ��ʱ�����c(AsO43-)Ϊa mol��L-1������˵�����жϷ�Ӧ�ﵽƽ��״̬����
A. c(I) �� 2a mol��L-1B. v(I-) �� 2v(AsO33-)
C. c(AsO43-)/c(I)���ٱ仯D. ��Һ��pH���ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��Aλ�ڵ�4���ڣ����̬ԭ����6��δ�ɶԵ��ӣ�Ԫ��B��ԭ�����������������ڲ����������3����Ԫ��C��̬ԭ�ӵ�3p�������4�����ӣ�Ԫ��D���л���ز����ٵ�����Ԫ�أ�E�����ڱ���ԭ�Ӱ뾶��С��Ԫ�ء�
��1��Ԫ��B��Ԫ��C���γɶ��ֻ����
��Ԫ��B��C�е縺�Խϴ����______����Ԫ�ط��ţ���
������CB42���Ŀռ乹��Ϊ______����������������
��2��B��E�γɼ�����ķе����C��E�γɵļ������ԭ��______��
��3����A3+����Һ��NaCl����ˮ��Ӧ�ɵõ�������Na[A(NH3)2Cl4]��
�ٻ�̬Aԭ�ӵĵ����Ų�ʽ��______��
��1 mol�����Na[A(NH3)2Cl4]�к��Ҽ�����ĿΪ______mol��
��4����ͼΪB��D��E����Ԫ���γɵ�һ�ֻ���������ģ�ͣ��Ʋ�û�������Dԭ�ӵ��ӻ���ʽ______��
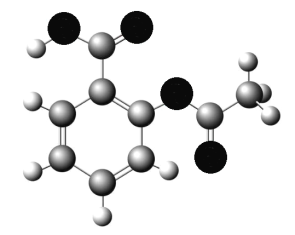
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���������������ԭ�����͵���
A. ����ɫ��NO2����ѹ����ɫ�ȱ�����dz
B. ��ѹ�ȳ�ѹ�����ںϳ�SO3�ķ�Ӧ
C. ������������ڰ��ĺϳ�
D. ��ҵ��ȡ������Na(l)+KCl(l)![]() NaCl(l)+K(g)ѡȡ���˵��¶ȣ�ʹK��������ӷ�Ӧ������з������
NaCl(l)+K(g)ѡȡ���˵��¶ȣ�ʹK��������ӷ�Ӧ������з������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1941���è����ֲ���з�������ľ�����������������ҩ��������ҩ������ҩ�ȡ�ͨ�������������⻯��Ӧ���Եõ����⾣����������������Ч���������Ϊ�о����⾣�������ĺϳɺ����ʣ��������·�Ӧ��

![]() A��
A�� ��
��![]() B
B![]() C��
C�� ��
��![]() D��
D�� ��
��![]() E��
E�� ��
��
��1��A�й���������Ϊ____________��д��B�Ľṹ��ʽ__________________________
��2��д��B��C�ķ�Ӧ����ʽ___________________________����Ӧ������_______________________��
��3��D���ʵ�����̼��________________��
��4��д��ͬʱ��������������D��һ��ͬ���칹��Ľṹ��ʽ��________ _��
���ܷ���������Ӧ����������һ����Ԫ������������ֻ��3�ֲ�ͬ��ѧ�������⡣
��5����������еķ�Ӧ����д���� �ϳ�
�ϳ� ���IJ��ϳ�·��ͼ�����Լ���ѡ����________________
���IJ��ϳ�·��ͼ�����Լ���ѡ����________________

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com