
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) △H=-285.8 kJ·mol-1
O2(g)=H2O(l) △H=-285.8 kJ·mol-1
②H2O(g)=H2(g)+![]() O2(g) △H=+241.8 kJ·mol-1
O2(g) △H=+241.8 kJ·mol-1
③C(s)+![]() O2(g)= CO(g) △H=-110.5 kJ·mol-1
O2(g)= CO(g) △H=-110.5 kJ·mol-1
④CO2(g)=C(s)+O2(g) △H=+393.5 kJ·mol-1
回答下列问题:
(1)上述反应中属于放热反应的是_________________________。
(2)H2的燃烧热为____________,C的燃烧热为_____________。
(3)CO燃烧时的热化学反应方程式为______________________________。
【答案】①③ 285.8kJ/mol 393.5 kJ/mol ![]()
【解析】
(1)放热反应时,焓变小于零;
(2)燃烧热为1mol可燃物完全燃烧生成稳定的氧化物时,释放的热量;
(3)根据盖斯定律计算。
(1)放热反应时,焓变小于零,则放热反应为①③;
(2)燃烧热为1mol可燃物完全燃烧生成稳定的氧化物时,释放的热量,则①为氢气的燃烧热的方程式,其燃烧热为285.8kJ/mol;C的燃烧热为④的逆过程释放的热量,为393.5kJ/mol;
(3)根据盖斯定律,-(③+④)即可得到 CO(g)+![]() O2(g) =CO2(g) ,△H=-(393.5-110.5)=-283.0 kJ/mol。
O2(g) =CO2(g) ,△H=-(393.5-110.5)=-283.0 kJ/mol。


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )

A. 加入催化剂,减小了反应的热效应
B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式:H2O2===H2O+1/2 O2 ΔH>0
D. 反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
B.分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种
C.![]() 分子中至少有11个碳原子处于同一平面上
分子中至少有11个碳原子处于同一平面上
D.1mol有机物 一定条件下能和7molNaOH反应
一定条件下能和7molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,pH变化曲线如图所示(忽略温度),以下叙述正确的是
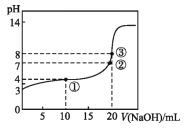
A.根据图中数据可计算出K值约为1×10-5
B.①②③点水的电离程度由大到小的顺序为:②>③>①
C.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
D.点③时c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图三条曲线表示不同温度下水的离子积常数,下列说法不正确的是
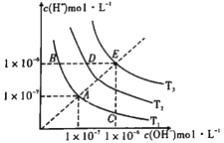
A. 图中温度:T3>T2>T1
B. 图中pH关系是:pH(B)=pH(D)=pH(E)
C. 图中五点Kw间的关系:E>D>A=B=C
D. C点可能是显酸性的盐溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,
计算a=_______。
(2)反应达到平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的百分含量(体积分数)为25%。计算:平衡时NH3的物质的量为_____________。
(3)原混合气体与平衡混合气体的总物质的量之比
n(始): n(平)=____________。
(4)原混合气体中a : b=_______________。
(5)达到平衡时,N2和H2的转化率![]() (N2):
(N2):![]() (H2)=______________。
(H2)=______________。
(6)平衡混合气体中n(N2): n(H2): n(NH3)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.棉花、麻、羊毛、蚕丝的主要化学成分都是蛋白质
B.淀粉、纤维素、氨基酸、蛋白质在一定条件下都能水解
C.皂化反应完全后,向反应液中加入热的饱和食盐水,容器底部有固体析出
D.可用水鉴别乙醇、苯和四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数![]() 随溶液pH的变化曲线如下图所示。下列说法正确的是( )
随溶液pH的变化曲线如下图所示。下列说法正确的是( )
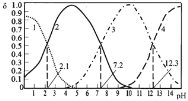
A.曲线1和曲线2分别表示![]() (H3PO4)和
(H3PO4)和![]() (HPO42-)的变化
(HPO42-)的变化
B.25℃时,H3PO4的电离常数K1=10-2.1
C.pH=7.2时,溶液中c(H2PO4-)+c(HPO42-)+c(OH-)=c(Na+)+c(H+)
D.pH=12.3时,溶液中由水电离出的c(H+)=10-12.3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式)。
②分离操作①中所用到的玻璃仪器有____________。
③洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________。
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)在实验中多次用到玻璃棒,其作用有三个,分别是______________、______________、______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com