
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,
计算a=_______。
(2)反应达到平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的百分含量(体积分数)为25%。计算:平衡时NH3的物质的量为_____________。
(3)原混合气体与平衡混合气体的总物质的量之比
n(始): n(平)=____________。
(4)原混合气体中a : b=_______________。
(5)达到平衡时,N2和H2的转化率![]() (N2):
(N2):![]() (H2)=______________。
(H2)=______________。
(6)平衡混合气体中n(N2): n(H2): n(NH3)=______________。
【答案】16mol 8mol 5:4 2:3 1:2 3:3:2
【解析】
(1)根据三段式计算;
(2)计算出混合气体总的物质的量,利用体积分数计算氨气的物质的量;
(3)利用差量法计算原混合气体的物质的量;
(4)原混合气体的物质的量减去氮气的物质的量为氢气的物质的量,据此计算;
(5)根据差量法计算出反应消耗的氮气和氢气的物质的量,计算出转化率;
(6)根据①②中数据计算出达到平衡时,反应混合物各组分的物质的量,据此计算。
(1)根据方程式计算:
N2(g)+3H2(g)2NH3(g),
起始: a b 0
转化: 3 9 6
t时刻:a3 b9 6
a3=13,则a=16,
故答案为:16;
(2)反应达平衡时,混合气体为![]() =32mol,其中NH3的物质的量为32mol×25%=8mol,故答案为:8mol;
=32mol,其中NH3的物质的量为32mol×25%=8mol,故答案为:8mol;
(3) N2(g)+3H2(g)2NH3(g),物质的量减少△n
1mol 3mol 2mol 2mol
转化: 4mol 12mol 8mol 8mol
故原混合气体为32mol+8mol=40mol,
则原混合气体与平衡混合气体的物质的量之比n(始):n(平)=40mol:32mol=5:4,
故答案为:5:4;
(4)由(1)知a=16mol,则b=40mol16mol=24mol,所以:a:b=16mol:24mol=2:3,
故答案为:2:3;
(5)反应转化的氮气物质的量为4mol,转化率为:![]() ×100%=25%,
×100%=25%,
转化的氢气物质的量为12mol,转化率为:![]() ×100%=50%,
×100%=50%,
达到平衡时,N2和H2的转化率之比a(N2):a(H2)=25%:50%=1:2,
故答案为:1:2;
③平衡混合气的组成为:N2为16mol4mol=12mol,NH3为8mol,H2为32mol12mol8mol=12mol,
平衡混合气体中,n(N2):n(H2):n(NH3)=12mol:12mol:8mol=3:3:2,
故答案为:3:3:2。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式中,不正确的是( )
A.防止FeCl2溶液变质而加入Fe粉:2Fe3++Fe=3Fe2+
B.向铜粉中滴加稀硝酸,产生气体:Cu+4H++2NO![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
C.向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++2OH-=Cu(OH)2↓
D.Na2O2是重要的供氧剂:2Na2O2+2H2O=4Na++4OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是
3C(g)+4D(g)反应中,表示该反应速率最快的是
A.v(A)=8 mol·L-1·min-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一密闭容器中进行,下列说法正确是
CO(g)+H2(g)在一密闭容器中进行,下列说法正确是
A.保持容器体积不变,增加C的物质的量,反应速率增大
B.保持容器体积不变,充入N2容器内气体压强增大,化学反应速率增大
C.保持压强不变,充入N2容器内气体压强不变,化学反应速率减小
D.保持容器体积不变,随着反应进行气体物质的量增多,压强增大,反应速率逐渐加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) △H=-285.8 kJ·mol-1
O2(g)=H2O(l) △H=-285.8 kJ·mol-1
②H2O(g)=H2(g)+![]() O2(g) △H=+241.8 kJ·mol-1
O2(g) △H=+241.8 kJ·mol-1
③C(s)+![]() O2(g)= CO(g) △H=-110.5 kJ·mol-1
O2(g)= CO(g) △H=-110.5 kJ·mol-1
④CO2(g)=C(s)+O2(g) △H=+393.5 kJ·mol-1
回答下列问题:
(1)上述反应中属于放热反应的是_________________________。
(2)H2的燃烧热为____________,C的燃烧热为_____________。
(3)CO燃烧时的热化学反应方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下:
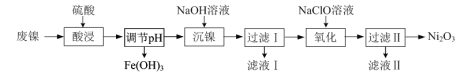
(1)“调节pH”后检验溶液中不再存在Fe3+的方法是______。
(2)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是______。
(3)“滤液Ⅱ”所含阴离子主要为Cl-,写出“氧化”时反应的离子方程式:______。
(4)若“氧化”反应不充分,所制Ni2O3样品中会混有Ni(OH)2。为测定样品中Ni2O3的质量分数,进行实验:称取5.000 g样品,加入足量硫酸后再加入100 mL 1.0 mol·L-1的Fe2+标准溶液,充分反应,加水定容至200 mL。取出20.00 mL,用0.040 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定Ni2O3的质量分数。测定过程中涉及反应如下:Ni2O3+Fe2++H+=Ni2++Fe3++H2O(未配平);Fe2++MnO4-+H+=Fe3++Mn2++H2O(未配平)______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的离子浓度与溶液pH的变化关系如图所示。下列叙述正确的是( )
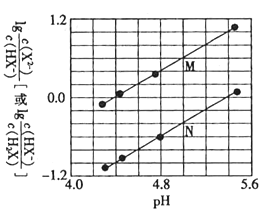
A.Ka1(H2X)的数量级为![]()
B.曲线N表示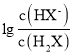 与pH的变化关系
与pH的变化关系
C.NaHX溶液中:c(H+)<c(OH-)
D.当混合物呈中性时,c(Na+)>c(X2-)>c(HX-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是( )
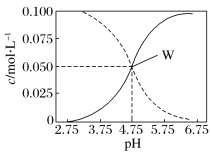
A. pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 溶液中:c(H+)+c(Na+)=c(CH3COO-)+c(OH-)
C. 由W点可以求出25℃时CH3COOH的电离常数
D. pH=4的溶液中:c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释中,不正确的是![]()
A.水很稳定![]() 以上才会部分分解
以上才会部分分解![]() 是因为水中含有大量的氢键所致
是因为水中含有大量的氢键所致
B.由于NaCl晶体和CsCl晶体中正负离子半径比不相等,所以两晶体中离子的配位数不相等
C.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
D.MgO的熔点比![]() 高主要是因为MgO的晶格能比
高主要是因为MgO的晶格能比![]() 大
大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com