
【题目】自然界中氯化钠是由1123Na 与1735Cl 和1735Cl所构成的。已知氯元素的相对原子质量是35.5,则 11.7g 氯化钠中,含1735Cl 的质量为
A.1.75gB.1.85gC.5.25gD.5.55g
科目:高中化学 来源: 题型:
【题目】(1)某烃的结构简式是![]() ,分子中饱和碳原子数为 _________,可能在同一平面上的碳原子数最多为 _________
,分子中饱和碳原子数为 _________,可能在同一平面上的碳原子数最多为 _________
(2)从某些植物树叶提取的挥发油中含有下列主要成分:
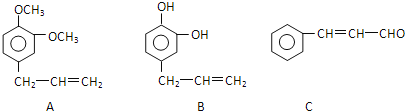
①C的含氧官能团名称为______。
②在这三种物质中,_______显酸性,________能发生银镜反应(填A、B或C)
③这三种物质都不能发生的反应有 __________。
A. 氧化反应 B.取代反应 C.消去反应 D.还原反应
④1 mol A与足量的浓溴水充分反应,消耗溴单质的物质的量为______ 。
⑤C发生加聚反应的产物的结构简式为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行反应:3A(g)+2B(g) ![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后的压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后的压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K=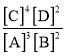 B.此时,B的平衡转化率是35%
B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡正向移动,化学平衡常数增大D.增加C,B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
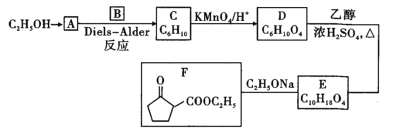
【题目】有机合成在制药工业上有着极其重要的地位。某新型药物F是一种合成药物的中间体,其合成路线如图所示:
已知:①Diels-Alder反应:![]()
② ![]() (R、R′均为烃基)
(R、R′均为烃基)
回答下列问题:
(1)A的产量标志着一个国家石油化工发展水平,则CH3CH2OH→A所需试剂、条件分别为______、______。
(2)B的化学名称是______;A→C的反应类型为______。
(3)F中官能团的名称是______。
(4)分子式为C6H10的有机物其结构不可能是______![]() 填标号
填标号![]() 。
。
A.含有两个环的环状有机物
B.含有一个双键的直链有机物
C.含有两个双键的直链有机物
D.含有一个三键的直链有机物
(5) D→E的化学方程式为______。
(6)已知炔烃与二烯烃也能发生Diels-Alder反应。则以CH2=CH-CH=CH2和HC≡CH为原料合成![]() 的路线图为______
的路线图为______![]() 无机试剂任选用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件
无机试剂任选用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知尿素的结构式为:![]() ,尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
,尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)C、N、O三种元素的电负性由大到小顺序是__________。
(2) NH4+中H—N—H键角比NH3中H—N—H键角大,原因为______________________。
(3)美国科学家合成了结构呈“V”形的N5+,已知该离子中各原子均达到8电子稳定结构。则有关该离子的下列说法中正确的是_____。
A.每个N5+中含有35个质子和36个电子 B.该离子中有非极性键和配位键 C.该离子中含有2个π键 D.与PCl4+互为等电子体
(4)Fe(Ⅲ)除可与H2NCONH2形成配合物[Fe(H2NCONH2)6](NO3)3外,FeCl3溶液也可与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能因发生化学反应而使溴水褪色,又能使高锰酸钾酸性溶液褪色的是( )
①CH3CH2CH2CH3 ②CH3CH2CH===CH2

A.①②③④ B.②③④
C.②④ D.只有②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4L氯仿中含有的氯原子数目为3NA
B.1mol羟基中含有的电子数为10NA
C.常温常压下,50gC7H16分子中含有的共价键数目为11NA
D.14g乙烯与2-丁烯混合物中含有碳原子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)甲醛与银氨溶液的反应的化学方程式:___;
(2)苯酚和碳酸钠反应的化学方程式:___;
(3)2-溴丙烷的消去反应方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com