
【题目】明矾[KAl(SO4)212H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料 — 铝灰(含 Al、Al2O3 及少量 SiO2 和 FeOxFe2O3)可制备明矾。工艺流程如下:

回答下列问题:
(1)欲配制 480 ml 1.0 mol / L H2SO4 溶液,需要 18 mol / L H2SO4 溶液的体积是 _______,已有下列仪器:烧杯,量筒,胶头滴管,玻璃棒,还需用到的仪器是 _____________。
(2)“酸浸”过程中“,酸浸铁”发生反应的离子方程式是 ______________。
(3)明矾净水的原理是 _____________(用离子方程式表示)。
(4)检验滤液 A 中是否存在 Fe2+ 的实验操作是 __________________。
(5)在滤液 A 中加入高锰酸钾溶液的目的是 ________________(用离子方程式表示)(该条件下 MnO4- 转化为 Mn2+)
(6)已知:加入 MnSO4,Mn2+ 可与 MnO4- 反应生成 MnO2,该反应氧化剂与还原剂的物质的量之比为 ____________。
(7)操作Ⅱ是 ___________、__________、过滤、洗涤、干燥。
【答案】27.8mL 500mL容量瓶 FeO·xFe2O3+(2+6x)H+= Fe2++2x Fe3++(3x+1)H2O( Al3++3H2O![]() Al(OH)3(胶体)+3H+ 取滤液少许于试管中,滴加铁氰化钾溶液,如果产生蓝色沉淀则有Fe2+ (或滴加酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色则有Fe2+) 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 2:3 蒸发浓缩 冷却结晶
Al(OH)3(胶体)+3H+ 取滤液少许于试管中,滴加铁氰化钾溶液,如果产生蓝色沉淀则有Fe2+ (或滴加酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色则有Fe2+) 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 2:3 蒸发浓缩 冷却结晶
【解析】
⑴欲配制 480 ml 1.0 mol / L H2SO4 溶液,需要 18 mol / L H2SO4 溶液的体积是![]() 即27.8 mL,
即27.8 mL,
因配制480 mL溶液,无480mL容量瓶,必须先配500mL溶液,再取出480 mL,已有下列仪器:烧杯,量筒,胶头滴管,玻璃棒,还需用到的仪器是500 mL容量瓶,
故答案为27.8 mL;500 mL容量瓶;
⑵“酸浸”过程中“,酸浸铁”发生反应的离子方程式是FeO·xFe2O3+(2+6x)H+= Fe2++
2x Fe3+ +(3x+1)H2O,
故答案为FeO·xFe2O3+(2+6x)H+= Fe2++2x Fe3+ +(3x+1)H2O;
⑶明矾净水主要是铝离子水解生成氢氧化铝胶体而吸附水中的杂质,其原理是 Al3++3H2O![]() Al(OH)3(胶体)+3H+,
Al(OH)3(胶体)+3H+,
故答案为Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
⑷检验滤液A中是否存在Fe2+的实验操作是取滤液少许于试管中,滴加铁氰化钾溶液,如果产生蓝色沉淀则有Fe2+(或滴加酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色则有Fe2+),
故答案为取滤液少许于试管中,滴加铁氰化钾溶液,如果产生蓝色沉淀则有Fe2+ (或滴加酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色则有Fe2+);
⑸在滤液 A 中加入高锰酸钾溶液的目的是氧化亚铁离子,使转化为铁离子,为除掉铁离子做准备,反应原理5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
⑹已知:加入MnSO4,Mn2+可与MnO4-反应生成 MnO2,MnO4-反应生成 MnO2化合价降低三价做氧化剂,Mn2+反应生成MnO2化合价升高2价做还原剂,根据升降守恒,其氧化剂与还原剂的物质的量之比为2:3,
故答案为2:3;
⑺操作Ⅱ是从溶液到晶体的过程,即操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为蒸发浓缩;冷却结晶;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L四氯化碳分子数为NA
B. 常温下,16gO2和O3组成的混合气体中所含有的原子数为NA
C. 常温下,1mol/L的AlCl3溶液中含有的Cl-离子数为3NA
D. 18gNH4+离子中所含的电子总数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验可达到实验目的的是
A.用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液
B.向CH3CH2Br中滴入AgNO3溶液以检验溴元素
C.用溴的四氯化碳溶液吸收SO2气体
D.![]() 与NaOH的醇溶液共热制备CH3-CH=CH2
与NaOH的醇溶液共热制备CH3-CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
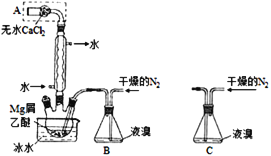
图1 图2
步骤1、三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴;
步骤2、缓慢通入干燥的氮气,直至溴完全导入三颈瓶中;
步骤3、反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4、室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性;
②MgBr2+3C2H5OC2H5![]() MgBr23C2H5OC2H5
MgBr23C2H5OC2H5
请回答:
(1)仪器A的名称是______;
(2)实验中不能用干燥空气代替干燥N2,原因是______________;
(3)步骤3中,第一次过滤除去的物质是_________________;
(4)有关步骤4的说法,正确的是__________________;
A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4﹣═MgY2
①滴定管洗涤前的操作是_______________________;
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500molL﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是__________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。下列说法错误的是
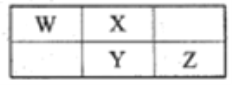
A. 单核阴离子的还原性Y强于X
B. W的气态氢化物与其最高价含氧酸反应生成离子化合物
C. X、Y、Z最简单氢化物中稳定性最弱的是Y
D. 在元素周期表中118号元素与Z位于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各对物质中,互为同系物的是
A. CH3-CH=CH2与![]() B.
B. ![]() 与
与![]()
C. 甲苯和二甲苯D. CH2=CH—CH=CH2和CH3CH2CH2C≡CH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是
A.除去粗盐中含有的硫酸钙杂质
![]()
B.检验亚硫酸钠试样是否变质
![]()
C.证明酸性条件H2O2的氧化性比I2强
![]()
D.检验某溶液中是否含有 Fe2+
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假如12C相对原子质量为24,以0.024kg12C所含的12C原子数为阿伏加德罗常数(NA),则下列说法正确的是( )
A.此时CO2的摩尔质量为88gmol﹣1
B.标准状况下44gCO2体积约为11.2L
C.44gCO2与28gCO含有相同数目的原子
D.NA个O2大约为6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法能说明反应2HI(g)![]() H2(g)+I2(g)已达到平衡状态的是( )
H2(g)+I2(g)已达到平衡状态的是( )
①单位时间内生成nmol H2的同时生成nmol HI
②一个H-H键断裂的同时有两个H-I键断裂
③当v正(HI)=2v逆(I2)时
④反应速率:v(H2)=v(I2)=0.5v(HI)
⑤当c(H2):c(I2):c(HI)=1:1:2时
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和体积一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再发生变化
⑩温度和压强一定时,混合气体的密度不再发生变化
A.②③⑥⑨B.①②⑤⑨⑩C.③⑥⑦⑩D.②⑥⑧⑨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com