
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。右图为RFC工作原理示意图,则有关说法正确的是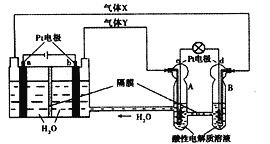
A. 当有0.1mol电子转移时,a极产生1.12LO2(标准状况下)
B. b极上发生的电极反应是:4H2O+4e―=2H2↑+4OH―
C. d极上发生的电极反应是:O2+4H++4e―=2H2O
D. c极上进行还原反应,B中的H+可以通过隔膜进入A
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子反应方程式正确的是:( )
A. 过量的二氧化碳通入NaOH溶液中:CO2+OH-==HCO3-
B. 氯气通入水中:Cl2+H2O==Cl-+ClO- +2H+
C. 硫酸亚铁溶液加入过氧化氢溶液Fe2++2H2O2+4H+==Fe3++4H2O
D. 向AlCl3溶液中过量的氨水:Al3+十4NH3·H2O==AlO2-十4NH4+十2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中某区域的一些元素多用于制造半导体材料,它们是
A. 左下方区域的金属元素 B. 右上方区域的非金属元素
C. 金属元素和非金属元素分界线附近的元素 D. 稀有气体元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物甲与![]() 发生酯反应的产物A是一种食用香料。11.6g甲完全燃烧可产生0.6mo1 CO2和0.6mo1 H2O。相同条件下,甲蒸气对氧气的相对密度为1.8125,甲分子为链状结构且不含甲基。回答下列问题:
发生酯反应的产物A是一种食用香料。11.6g甲完全燃烧可产生0.6mo1 CO2和0.6mo1 H2O。相同条件下,甲蒸气对氧气的相对密度为1.8125,甲分子为链状结构且不含甲基。回答下列问题:
(1)甲中的结构简式为_________________________。
(2)甲中含有的官能团名称为___________________。
(3)![]() 有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色,且苯环上的一氯代物有两种的同分异构体的结构简式为_______________________(任写两种)。
有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色,且苯环上的一氯代物有两种的同分异构体的结构简式为_______________________(任写两种)。
(4)已知:![]() (
(![]() )A的合成路线如下:
)A的合成路线如下:
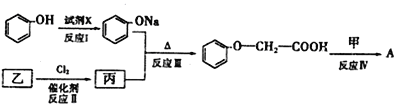
①试剂x不可选用________(填序号)
A.NaOH溶液 B.Na2 CO3溶液 C.NaHCO3溶液 D.Na
②乙的结构简式为___________________,反应Ⅲ的反应类型为______________。
③反应Ⅳ的化学方程式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol/LNaOH溶液滴定20.00mL 0.10mol/LHA溶液(滴定曲线见图)。下列说法正确的是( )

A. 此图可以表示从NaOH滴定盐酸的曲线
B. 图中D点状态时溶液中有:c(Na+)<c(A-)
C. 达到D、E状态时,均有:c(Na+)+c(H+)=c(A-)+c(OH-)
D. 当O<V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)> c(Na+)> c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
84消毒液
有效成分 NaClO
规格 1 000 ml
质量分数 25%
密度 1.19 g·cm-3
(1)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L-1。
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL该消毒液。下列说法正确的是________(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
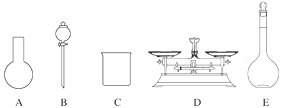
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(3)配制溶液的过程如下,该同学的错误步骤有(____)
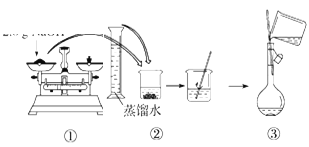
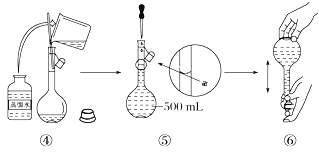
A.1处 B.2处 C.3处 D.4处
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。需用浓硫酸的体积为____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量极为丰富的元素。请回答下列问题:
(1)Li3N晶体中氮以N3-存在,基态N3―的电子排布式为_______________________。
(2) N≡N的键能为942 kJ · mol-1,N-N单键的键能为247 kJ · mol-1,计算说明N2中的___________键比____________键稳定(填“σ”或“π”)。
(3)(CH3)3NH+和AlCl4―可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂__________(填“大”或“小”),可用作__________(填代号)。
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3―形成的晶体结构如图所示。X的元素符号是_____________,与同一个N3―相连的X+有__________个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是 ( )
A. CaCO3(s) =CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
C. N2(g)+3H2(g)![]() 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大
D. 升高温度能使化学反应速率增大的主要原因是增加了反应物中活化分子的百分数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com