
【题目】化合物甲与![]() 发生酯反应的产物A是一种食用香料。11.6g甲完全燃烧可产生0.6mo1 CO2和0.6mo1 H2O。相同条件下,甲蒸气对氧气的相对密度为1.8125,甲分子为链状结构且不含甲基。回答下列问题:
发生酯反应的产物A是一种食用香料。11.6g甲完全燃烧可产生0.6mo1 CO2和0.6mo1 H2O。相同条件下,甲蒸气对氧气的相对密度为1.8125,甲分子为链状结构且不含甲基。回答下列问题:
(1)甲中的结构简式为_________________________。
(2)甲中含有的官能团名称为___________________。
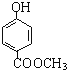
(3)![]() 有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色,且苯环上的一氯代物有两种的同分异构体的结构简式为_______________________(任写两种)。
有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色,且苯环上的一氯代物有两种的同分异构体的结构简式为_______________________(任写两种)。
(4)已知:![]() (
(![]() )A的合成路线如下:
)A的合成路线如下:
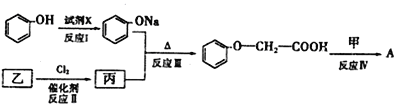
①试剂x不可选用________(填序号)
A.NaOH溶液 B.Na2 CO3溶液 C.NaHCO3溶液 D.Na
②乙的结构简式为___________________,反应Ⅲ的反应类型为______________。
③反应Ⅳ的化学方程式为_______________________________________________。
【答案】 CH2=CH-CH2-OH 碳碳双键、羟基  C CH3COOH 取代反应
C CH3COOH 取代反应 ![]()
![]()
![]()
【解析】(1)由题意可知,甲中含有羟基,甲蒸气对氧气的相对密度是1.8125,相同条件下的气体密度之比等于其相对分子质量之比,所以甲的相对分子质量为1.8125×32=58,11.6g甲的物质的量=11.6g÷58g/mol=0.2mol,质量守恒可知,参加反应的氧气的质量=0.6mol×44g/mol+0.6mol×18g/mol-11.6g=25.6g,氧气物质的量=25.6g÷32g/mol=0.8mol,根据氧原子守恒,可知11.6g甲中n(O)=0.6mol×2+0.6mol-0.8mol×2=0.2mol,根据原子守恒可知,甲分子中N(C)=0.6mol÷0.2mol=3、N(H)=0.6mol×2/0.2mol=6、N(O)=0.2mol÷0.2mol=1,故甲的分子式为C3H6O,甲分子中不含甲基,且为链状结构,其结构简式是CH2=CH-CH2-OH;(2)甲的结构简式为CH2=CH-CH2-OH,含有的官能团为碳碳双键、羟基;(3)能与FeCl3溶液发生显色反应说明含有酚羟基,且有2种一硝基取代物,说明苯环上有2个取代基且处于对位位置,所以其同分异构体是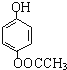 、
、 、
、 ;(4)苯酚和氢氧化钠或钠反应生成苯酚钠,催化剂条件下,乙和氯气反应生成丙,丙和苯酚钠反应生成
;(4)苯酚和氢氧化钠或钠反应生成苯酚钠,催化剂条件下,乙和氯气反应生成丙,丙和苯酚钠反应生成![]() ,结合反应信息可知,丙是ClCH2COOH,故乙为乙酸,CH2=CH-CH2-OH和
,结合反应信息可知,丙是ClCH2COOH,故乙为乙酸,CH2=CH-CH2-OH和![]() 发生酯化反应生成
发生酯化反应生成![]() 。
。
①苯酚具有酸性但酸性弱于醋酸、碳酸,所以苯酚能和钠、氢氧化钠反应生成苯酚钠,不能和醋酸钠、碳酸氢钠反应,答案选C;②由以上分析可知乙为CH3COOH,与氯气发生取代反应生成ClCH2COOH;③在催化剂、加热条件下,CH2=CH-CH2-OH和![]() 发生酯化反应生成A,反应方程式为
发生酯化反应生成A,反应方程式为![]() 。
。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】向X溶液中加入Y试剂,产生沉淀的示意图与下图所示情形吻合的是(注意线段的斜率)
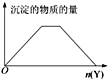
A. 向NaOH和Ca(OH)2的混合溶液中通入CO2
B. 向HCl和AlCl3的混合溶液中滴加NaOH
C. 向NH4Al(SO4)2溶液中滴加NaOH
D. 向NH4Cl和MgCl2的混合溶液中滴加NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
Zn 在现代工业中对于电池制造有不可磨灭的地位,锌还是人体必需的微量元素之一,在人体生长发育、生殖遗传、免疫、内分泌等重要生理过程中起着极其重要的作用。
(l)元素Zn在周期表中的位置为_____,基态Zn原子的电子排布式为_____。
(2)在[Zn(NH3)4]2+中,Zn2+提供4s和4p共四个空轨道,与4个NH3分子形成_____键,Zn2+采取sp3杂化,预测[Zn(NH3)4]2+的空间构型为______。
(3)金属Zn晶体密置层采取…ABAB…方式堆积,其堆积方式名称为:______,配位数为:____。
(4)闪锌矿(ZnS )晶胞如图所示
白球为S2-离子、黑球为Zn2+离子,与Zn2+距离最近的四个S2-所围成的空间构型为_____,若晶胞参数为a,则Zn2+与S2-最近距离为______(用含a的代数式表示)。

(5)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,后者较前者高是由于______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学常见的物质,其中甲、乙为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是( )
![]()
A. 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序一定为甲<丙<戊
B. 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙可能为Na2O2
C. 若丙、丁混合产生白烟,且丙分子为18电子分子,丁分子为10电子分子,则乙的水溶液可能具有漂白性
D. 若甲既能与盐酸反应又能与NaOH溶液反应,则戊可能属于两性氢氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。一种制备草酸钴晶体(CoC2O4·2H2O)的工艺流程如下:

已知:①水钴矿主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等杂质。
②浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(金属离子浓度以0.01mol·L-1计)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀pH | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1) 写出浸出过程中Co(OH)3发生反应的离子方程式:____________________。
(2) NaClO3的作用是_______________________。
(3) 加Na2CO3调pH的范围应该在_____之间。加入萃取剂的目的是____________。
(4) 在空气中加热5.49g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是____________________。[M(CoC2O4·2H2O=183g/mol]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。右图为RFC工作原理示意图,则有关说法正确的是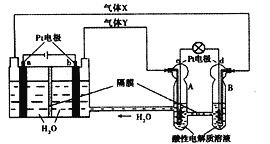
A. 当有0.1mol电子转移时,a极产生1.12LO2(标准状况下)
B. b极上发生的电极反应是:4H2O+4e―=2H2↑+4OH―
C. d极上发生的电极反应是:O2+4H++4e―=2H2O
D. c极上进行还原反应,B中的H+可以通过隔膜进入A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示:

(1)则25 ℃时水的电离平衡曲线应为________(填“A”或“B”),请说明理由________________。
(2)在25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,pH1与pH2之间应满足的关系是_______________________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积的关系如图,下列说法正确的是( )

①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A. 晶体硅的熔点高、硬度大,可用作半导体材料
B. 浓H2SO4具有脱水性,可用来干燥HCl
C. 明矾易溶于水,可用作净水剂
D. Na具有强还原性,可用于高温下与TiCl4反应制备Ti
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com