
【题目】
Zn 在现代工业中对于电池制造有不可磨灭的地位,锌还是人体必需的微量元素之一,在人体生长发育、生殖遗传、免疫、内分泌等重要生理过程中起着极其重要的作用。
(l)元素Zn在周期表中的位置为_____,基态Zn原子的电子排布式为_____。
(2)在[Zn(NH3)4]2+中,Zn2+提供4s和4p共四个空轨道,与4个NH3分子形成_____键,Zn2+采取sp3杂化,预测[Zn(NH3)4]2+的空间构型为______。
(3)金属Zn晶体密置层采取…ABAB…方式堆积,其堆积方式名称为:______,配位数为:____。
(4)闪锌矿(ZnS )晶胞如图所示
白球为S2-离子、黑球为Zn2+离子,与Zn2+距离最近的四个S2-所围成的空间构型为_____,若晶胞参数为a,则Zn2+与S2-最近距离为______(用含a的代数式表示)。

(5)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,后者较前者高是由于______。
【答案】 第四周期第IIB族 [Ar]3d104s2 配位键 正四面体 六方最密堆积 12 正四面体 ![]() a ZnO的晶格能比ZnS的晶格能大
a ZnO的晶格能比ZnS的晶格能大
【解析】(l)元素Zn的原子序数是30,在周期表中的位置为第四周期第IIB族,基态Zn原子的电子排布式为[Ar]3d104s2。(2)在[Zn(NH3)4]2+中,Zn2+提供4s和4p共四个空轨道,N原子含有孤对电子,因此与4个NH3分子形成配位键,Zn2+采取sp3杂化,因此[Zn(NH3)4]2+的空间构型为正四面体。(3)金属Zn晶体密置层采取…ABAB…方式堆积,其堆积方式名称为六方最密堆积,配位数为12。(4)根据晶胞结构可判断与Zn2+距离最近的四个S2-所围成的空间构型为正四面体;Zn2+与S2-最近距离为晶胞体对角线的1/4,若晶胞参数为a,则体对角线是![]() ,所以Zn2+与S2-最近距离为
,所以Zn2+与S2-最近距离为![]() 。(5)由于硫离子半径大于氧离子半径,ZnO的晶格能比ZnS的晶格能大,所以氧化锌的熔点高于硫化锌。
。(5)由于硫离子半径大于氧离子半径,ZnO的晶格能比ZnS的晶格能大,所以氧化锌的熔点高于硫化锌。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 将铜丝插入稀硝酸中:Cu+4H++2NO![]() ===Cu2++2NO2↑+H2O
===Cu2++2NO2↑+H2O
B. NaHCO3溶液中加少量Ba(OH)2溶液:HCO![]() +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
C. 硫化钠水溶液呈碱性:S2-+2H2O===H2S↑+2OH-
D. 在酸性碘化钾溶液中滴加双氧水:2I-+2H++H2O2===I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于0.1 mol/L Na2SO3溶液,下列叙述正确的是
A. c(Na+) : c(SO32―) < 2 : 1
B. c(Na+) = 2 c (SO32―) + c(HSO3―) + c(H2SO3)
C. c(Na+) + c(H+) = 2 c (SO32―) + 2 c(HSO3―) + c(OH―)
D. 加入少量NaOH固体,c(SO32―) 与c(Na+) 均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接4个不同的原子或原子团,则这种碳原子称为“手性碳原子”,凡有一个手性碳原子的物质一定具有光学活性。已知某有机物结构如下:具有光学活性,当它发生下列反应后生成的有机物仍然具光学活性的是
A. 与NaOH溶液共热 B. 与甲酸发生酯化反应
C. 与氧气发生催化氧化 D. 在催化剂存在下与H2作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中某区域的一些元素多用于制造半导体材料,它们是
A. 左下方区域的金属元素 B. 右上方区域的非金属元素
C. 金属元素和非金属元素分界线附近的元素 D. 稀有气体元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氢化物有多种,在科学技术和生产中有重要的应用。根据题意完成下列计算:
(1)某氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,确定该氢化物的分子式为____________。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为____________L。
(2)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为
6NO+4NH3=5N2+6H2O① 6NO2+ 8NH3=7N2+12H2O②
反应①中氧化剂是__________,还原剂与还原产物物质的量之比_______________;如NO与NO2混合气体87g被过量氨水(质量分数0.300)完全吸收,产生50.4L氮气(标准状况下测定),则计算混合气体中NO与NO2的体积比为多少____________?(要求写计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
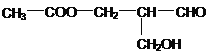
【题目】化合物甲与![]() 发生酯反应的产物A是一种食用香料。11.6g甲完全燃烧可产生0.6mo1 CO2和0.6mo1 H2O。相同条件下,甲蒸气对氧气的相对密度为1.8125,甲分子为链状结构且不含甲基。回答下列问题:
发生酯反应的产物A是一种食用香料。11.6g甲完全燃烧可产生0.6mo1 CO2和0.6mo1 H2O。相同条件下,甲蒸气对氧气的相对密度为1.8125,甲分子为链状结构且不含甲基。回答下列问题:
(1)甲中的结构简式为_________________________。
(2)甲中含有的官能团名称为___________________。
(3)![]() 有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色,且苯环上的一氯代物有两种的同分异构体的结构简式为_______________________(任写两种)。
有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色,且苯环上的一氯代物有两种的同分异构体的结构简式为_______________________(任写两种)。
(4)已知:![]() (
(![]() )A的合成路线如下:
)A的合成路线如下:
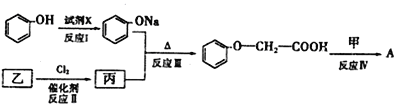
①试剂x不可选用________(填序号)
A.NaOH溶液 B.Na2 CO3溶液 C.NaHCO3溶液 D.Na
②乙的结构简式为___________________,反应Ⅲ的反应类型为______________。
③反应Ⅳ的化学方程式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO![]() 、CO
、CO![]() 、SiO
、SiO![]() 、Cl-中的几种,现进行如下实验:
、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成
②另取少量原溶液,逐滴加入5 mL 0.2 mol·L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失。
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到白色沉淀。
下列说法中正确的是( )
A. 该溶液中一定不含Ba2+、Mg2+、Al3+、SiO![]() 、Cl-
、Cl-
B. 该溶液中一定含有K+、AlO![]() 、CO
、CO![]() 、Cl-
、Cl-
C. 该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片)
D. 可能含有Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com