
【题目】在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6gX与Y完全反应后,生成4.4gR。则在此反应中Y和M的质量之比为
A.16:9 B.23:9 C.32:9 D. 46:9
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液.向0.1mol·L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
实验二:向2mL FeCl2溶液中滴加2滴0.1mol·L-1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5mol·L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
(1)用离子方程式表示步骤二中溶液变红的原因:________________。
(2)甲探究步骤二中溶液褪色的原因:
Ⅰ.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
Ⅱ.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
Ⅲ.向2mL 0.1mol·L-1 FeCl3溶液中滴加2滴0.1mol·L-1KSCN溶液,变红,通入O2,无明显变化。
①实验I的说明__________________;
②实验Ⅲ的目的是____________________。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)①甲直接用FeCl2·4H2O配制_________mol·L-1的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去,进一步探究其原因:
②.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无.测所配FeCl2溶液的pH约为3.由此,乙认为红色不褪去的可能原因是:____________________。
③.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-.乙利用上述部分试剂,通过实验排除了这一可能.乙的实验操作及现象是:
步骤 | 试剂及操作 | 现 象 |
i | 生成白色沉淀 | |
ii | 向i所得溶液中滴加0.1mol·L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.把过量新制的氯水滴加到石蕊试液中,溶液颜色先变蓝后褪色
B.自来水厂用氯气给水消毒,是因为氯气与水反应生成的HClO具有强氧化性
C.Cl2、Cl-均有毒
D.Cl2、HClO、H2O2都具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空:
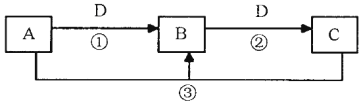
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则反应②的离子方程式为 ;实验室保存C的水溶液应加入 (填试剂名称)。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为 。
(3)若C是一种能形成硫酸型酸雨的污染性气体,D是一种能支持燃烧和呼吸的气体,则反应③中氧化产物和还原产物的质量比为 。
(4)若D是一种常见的温室气体,A、B、C的的焰色反应都呈黄色,则反应③的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为 。
(2)已知:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN![]() N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2 2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将___________能转化为__________能。其电极反应式分别为:负极_________________,正极____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于物质分类正确的组合是
组合分类 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaF2 | CO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】施用碳酸氢铵、氯化铵等铵态氮肥能够促进农作物生长,但是铵态氮肥不能与碱性肥料如草木灰混合使用,其原因是铵态氮肥( )
A.易溶于水
B.能与碱反应
C.受热易分解
D.在水中易发生电离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com