
【题目】Na2SO3的氧化反应:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)△H=m kJmol﹣1 . 其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段.
(1)已知O2(g)O2(aq)△H=nkJmol﹣1 , Na2SO3溶液与O2(g)反应的热化学方程式为
(2)291.5K时,1.0L溶液中Na2SO3初始量分别为4、6、8、12mmol,溶解氧浓度初始值为9.60mgL﹣1 , 每5s记录溶解氧浓度,实验结果如图.当Na2SO3的初始量为12mmol,经过20s溶解氧浓度降为6.40mgL﹣1 , 则0﹣20s内Na2SO3的平均反应速率为molL﹣1s﹣1
(3)为确定贫氧区速率方程v=kca(SO32﹣)cb(O2)中a,b的值(取整数),分析实验数据.
c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
①当溶解氧浓度为4.0mgL﹣1时,c(Na2SO3)与速率数值关系如表,则a=
②当溶解氧浓度小于4.0mgL﹣1时,图中曲线皆为直线,则b= ,
(4)两个阶段不同温度的速率常数(k)之比如表.
反应阶段 | 速率方程 |
|
富氧区 | v=kc(SO32﹣)c(O2) | 1.47 |
贫氧区 | v=kca(SO32﹣)cb(O2) | 2.59 |
已知ln ![]() =﹣
=﹣ ![]() (
( ![]() ),R为常数,Ea(富氧区)Ea(贫氧区)(填“>”或“<”).
),R为常数,Ea(富氧区)Ea(贫氧区)(填“>”或“<”).
(5)结合图表分析,Na2SO3初始量不同时,划分富氧区与贫氧区的溶解氧浓度是否相同,为什么?.
(6)一定温度下,化学反应速率仅与决速步的反应物浓度有关.Na2SO3氧化反应历程涉及的
①SO32﹣+O2→SO5﹣
②SO5﹣+SO32﹣→SO52﹣+SO3﹣
③SO32﹣+SO32﹣→SO3﹣+SO32﹣
④SO32﹣+O2→SO5﹣
⑤SO52﹣+SO32﹣→2SO42﹣
富氧区与和贫氧区的决速步分别是、(填序号)
【答案】
(1)2Na2SO3(aq)+O2(g)=2Na2SO4(aq)△H=(m+n)kJ?mol﹣1
(2)1.00×10﹣5
(3)2;0
(4)<
(5)解:不同;因为Na2SO3初始浓度不同,溶解氧浓度与时间呈线性关系的起始溶解氧浓度不同;
(6)①;③
【解析】解:(1)已知:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)△H=m kJmol﹣1①O2(g)O2(aq)△H=nkJmol﹣1②
将方程式①+②得2Na2SO3(aq)+O2(g)=2Na2SO4(aq)△H=(m+n)kJmol﹣1;
所以答案是:2Na2SO3(aq)+O2(g)=2Na2SO4(aq)△H=(m+n)kJmol﹣1;(2)0﹣20s内溶解氧浓度变化量=(9.60﹣6.40)mg/L=3.20mg/L=3.20×10﹣3 g/L,则△c(O2)= ![]() =10﹣4 mol/L,根据方程式得△c(Na2SO3)=2△c(O2)=2×10﹣4 mol/L,0﹣20s内Na2SO3的平均反应速率v=
=10﹣4 mol/L,根据方程式得△c(Na2SO3)=2△c(O2)=2×10﹣4 mol/L,0﹣20s内Na2SO3的平均反应速率v= ![]() =1.00×10﹣5molL﹣1s﹣1;
=1.00×10﹣5molL﹣1s﹣1;
所以答案是:1.00×10﹣5;(3)①当溶解氧浓度为4.0mgL﹣1时,c(Na2SO3)与速率数值关系如表,v1:v2=c1a(SO32﹣):c2a(SO32﹣), ![]() =
= ![]() ,解得a=2;
,解得a=2;
所以答案是:2;
②当溶解氧浓度小于4.0mgL﹣1时,图中曲线皆为直线,说明该方程为一次函数,k为常数,v与c(SO32﹣)有关,溶解氧浓度对v无影响,所以b=0;
所以答案是:0;(4)ln ![]() 随着Ea的增大而增大,富氧区的ln
随着Ea的增大而增大,富氧区的ln ![]() 较小,故Ea(富氧区)<Ea(贫氧区);
较小,故Ea(富氧区)<Ea(贫氧区);
所以答案是:<;(5)从图表可知Na2SO3初始浓度不同,溶解氧浓度与时间呈线性关系的起始溶解氧浓度不同;
答:不同;因为Na2SO3初始浓度不同,溶解氧浓度与时间呈线性关系的起始溶解氧浓度不同;(6)富氧区的化学反应速率与SO32﹣和溶解氧的浓度有关,故富氧区与的决速步为①,贫氧区的化学反应速率与氧浓度无关,决速步为③;
所以答案是:①;③.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)),还要掌握化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%)的相关知识才是答题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用如图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
(1)写出该实验中生成乙烯的化学方程式 .
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 .
a.乙烯与溴水易发生取代反应b.使溴水褪色的反应,未必是加成反应
c.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后试管中另一实验现象后,证明反应中有乙烯生成,请简述这种这一实验现象 .
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加图2装置以除去乙醇蒸气和SO2 , 则A中的试剂是 , B中的试剂为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的用途(括号内为其用途)错误的是( )
A.SiO2(制光纤)
B.Si和Ge(半导体材料)
C.钢化玻璃(汽车窗玻璃)
D.氮化硅陶瓷(作导热剂)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醛A( ![]() )具有多种同分异构体.
)具有多种同分异构体.
(1)其中属于酯类化合物,且苯环只有一个支链的异构体有3种,分别写出它们的结构简式 ①;②;③;
(2)又知A中含有苯环,苯环上只有一个支链,且能与碳酸钠溶液反应生成气体,A的结构简式为: ;
(3)若A中含有苯环,能发生银镜反应,但不与NaOH溶液反应,则A结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池(如图)工作时,回答下列问题: 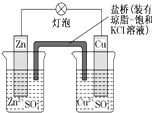
(1)(选填“Zn”或“Cu”)为原电池负极.
(2)在外电路中,电子从(选填“Zn”或“Cu”,下同)极流向极.
(3)正极反应式为
(4)电池反应的离子方程式为
(5)盐桥中的K+移向(选填“ZnSO4”或“CuSO4”)溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1﹣溴丙烷和2﹣溴丙烷分别与NaOH的乙醇溶液共热,关于两反应的说法正确的是( )
A.产物相同,反应类型相同
B.产物不同,反应类型不同
C.碳氢键断裂的位置相同
D.碳溴键断裂的位置相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥运会中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( ) 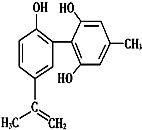
A.该物质与苯酚属于同系物
B.该物质不能使酸性KMnO4溶液褪色
C.1 mol该物质与浓溴水反应时最多消耗Br2为4 mol
D.该分子中的所有原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠与水反应:2Na+2H2O→2Na++2OH-+H2↑,关于该反应过程的叙述错误的是( )
A.生成了离子键B.破坏了极性共价键
C.破坏了金属键D.形成非极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com