
【题目】苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下:C6H5-CH3+2KMnO4![]() C6H5-COOK+KOH+2MnO2↓+H2O,C6H5-COOK+HCl→C6H5-COOH+KCl
C6H5-COOK+KOH+2MnO2↓+H2O,C6H5-COOK+HCl→C6H5-COOH+KCl
已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3g和6.9g。
(制备产品)30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在80℃下反应30min,装置如图所示:

(1)图中支管的作用是______
(2)相对于用酒精灯直接加热,用沸水浴加热的优点是_____,在本实验中,三颈烧瓶最合适的容积是_____(填字母)
A.50mL B.100mL C.200mL D.250mL
(分离产品)他们设计如下流程分离粗产品苯甲酸和回收甲苯:

(3)操作Ⅰ的名称是____;含杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是_____
(4)操作Ⅲ的名称是_____、____检验B中是否含有Cl-的方法如下:取少量B溶于水,在上层清液中滴加稀硝酸酸化的_____溶液,若产生白色沉淀,则B中含有Cl-。
【答案】平衡压强,使甲苯顺利滴下 便于控制温度恒定和使容器受热均匀 B 分液 蒸馏 冷却结晶 过滤 AgNO3溶液
【解析】
(1)在恒压滴液漏斗上的支管可以使液体上下气体压强一致;
(2)水浴加热可以控制温度恒定和使容器受热均匀;30.0mL甲苯和25.0mL 1mol/L高锰酸钾溶液混合体积为55.0mL,溶液体积在三颈瓶容积的![]() ~
~![]() 范围;
范围;
(3)分离互不相溶的液体采用分液方法分离,分离互溶且沸点不同的液体采用蒸馏方法;
(4)从溶液中得到固体采用蒸发浓缩、冷却结晶、过滤的方法;氯离子用硝酸银溶液检验,氯离子和银离子反应生成白色沉淀AgCl。
(1)在恒压滴液漏斗上的支管可以使液体上下气体压强一致,可以起到平衡压强,使甲苯顺利滴下的作用;
(2) 水浴加热可以控制温度恒定和使容器受热均匀;30.0mL甲苯和25.0mL 1mol/L高锰酸钾溶液混合体积为55.0mL,溶液体积在三颈瓶容积的![]() ~
~![]() 范围。如果混合溶液占三颈瓶的
范围。如果混合溶液占三颈瓶的![]() ,则三颈瓶容积为165mL,如果混合溶液占三颈瓶的
,则三颈瓶容积为165mL,如果混合溶液占三颈瓶的![]() ,则三颈瓶容积为82.5mL,所以选取100mL三颈瓶,故合理选项是B;
,则三颈瓶容积为82.5mL,所以选取100mL三颈瓶,故合理选项是B;
(3)分离互不相溶的液体采用分液方法分离,分离互溶且沸点不同的液体采用蒸馏方法,有机相和水相不互溶且都是液体,所以操作I采用分液方法分离;从有机相中分离互溶的液体采用蒸馏方法,所以操作II为蒸馏;
(4)从溶液中得到固体采用蒸发浓缩、冷却结晶、过滤的方法,所以操作III为冷却结晶、过滤;Cl-可以用AgNO3溶液检验,取B溶液,向其中加入硝酸酸化,再加入AgNO3溶液,若看到生成白色沉淀AgCl,就证明B溶液中含有Cl-,所以检验Cl-还需要的试剂是AgNO3溶液。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。
Ⅰ.羰基法提纯粗镍涉及的两步反应依次为:
①Ni(S)+4CO(g)![]() Ni(CO)4(g) ②Ni(CO)4(g)
Ni(CO)4(g) ②Ni(CO)4(g)![]() Ni(S)+4CO(g)
Ni(S)+4CO(g)
完成下列填空:
(1)在上述反应中断裂或形成的化学键有____(填序号)。
A.离子键 B.配位键 C.非极性共价键 D.金属键
(2)比较C元素和O元素分别形成的最简单气态氢化物的稳定性大小________。
(3)C、O、Ni元素的电负性由大到小排列顺序为______。
(4)化合物Ni(CO)4呈正四面体构型,Ni(CO)4中Ni原子的杂化类型为____。
(5)基态Ni原子的外围电子排布式___,价电子的轨道表示式为__________。
Ⅱ.研究金属镍及其化合物晶体结构具有重要意义。
(6)NiO、FeO的晶体结构类型均与氯化钠的相同,且Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO_______FeO(填“<”或“>”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____区元素,其基态原子的价电子排布式为_____。
(2)基态Na原子中,核外电子占据的原子轨道总数为____,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____(用元素符号表示)。
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________,1mol碳酸丙烯酯中键的数目为________.

(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____,该配离子包含的作用力为__(填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_____cm(用含ρ、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的电化学装置,下列叙述不正确的是( )

A. a和b用导线连接,电子由铁经过导线流向碳
B. a和b用导线连接,铁电极的电极反应式为:Fe-2e-===Fe2+
C. a、b分别连接直流电源正、负极,可以防止铁被腐蚀
D. a、b分别连接直流电源负、正极,电压足够大时,Na+向铁电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨。已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,通电时a电极质量增加,下列说法正确的是( )
2PbSO4+2H2O,通电时a电极质量增加,下列说法正确的是( )
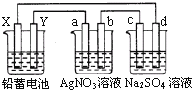
A. X极为负极
B. 放电时铅蓄电池正极的电极反应式为:PbO2+4H++SO42+4e==PbSO4+2H2O
C. c、d电极产生气体的物质的量之比为1:2
D. 电路中通过1 mol电子时,Y电极质量增加48 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌(Ag—Zn)可充电电池广泛用做各种电子仪器的电源,电解质为KOH。其电池总反应式为Ag2O + Zn + H2O![]() 2Ag + Zn(OH)2 ,下列说法正确的是( )
2Ag + Zn(OH)2 ,下列说法正确的是( )
A. 放电时Ag2O参与反应的电极为负极
B. 放电时正极附近的pH逐渐减小
C. 充电时阴极的电极反应为:Zn(OH)2 + 2e- = Zn + 2OH-
D. 充电时每生成1 mol Ag2O转移1 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. 溴乙烷在NaOH醇溶液中加热:CH3CH2CH2Br+NaOH![]() CH3CH2CH2OH+NaBr
CH3CH2CH2OH+NaBr
B. 苯酚钠溶液中通入少量二氧化碳:2![]() +CO2+H2O
+CO2+H2O![]()
![]() +Na2CO3
+Na2CO3
C. CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
D. CH3COOH + CH3CH218OH![]() CH3COOCH2CH3+H218O
CH3COOCH2CH3+H218O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com