
【题目】镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。
Ⅰ.羰基法提纯粗镍涉及的两步反应依次为:
①Ni(S)+4CO(g)![]() Ni(CO)4(g) ②Ni(CO)4(g)
Ni(CO)4(g) ②Ni(CO)4(g)![]() Ni(S)+4CO(g)
Ni(S)+4CO(g)
完成下列填空:
(1)在上述反应中断裂或形成的化学键有____(填序号)。
A.离子键 B.配位键 C.非极性共价键 D.金属键
(2)比较C元素和O元素分别形成的最简单气态氢化物的稳定性大小________。
(3)C、O、Ni元素的电负性由大到小排列顺序为______。
(4)化合物Ni(CO)4呈正四面体构型,Ni(CO)4中Ni原子的杂化类型为____。
(5)基态Ni原子的外围电子排布式___,价电子的轨道表示式为__________。
Ⅱ.研究金属镍及其化合物晶体结构具有重要意义。
(6)NiO、FeO的晶体结构类型均与氯化钠的相同,且Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO_______FeO(填“<”或“>”);
【答案】BD H2O>CH4 O>C>Ni sp3 3d84s2  >
>
【解析】
(1)根据反应①、②分析判断断开和形成的化学键;
(2)非金属性越强,气态氢化物越稳定;
(3)非金属性越强,电负性越强;
(4)化合物Ni(CO)4呈正四面体构型,中心原子Ni形成4个配位键,据此判断Ni(CO)4中Ni原子的杂化类型;
(5)Ni是28号元素,根据构造原理书写其核外电子排布式,据此解答;
(6)NiO和FeO晶体均为离子晶体,Ni2+和Fe2+电荷数相同,离子半径越小,晶格能越大,熔点越高。
(1)①Ni(S)+4CO(g)![]() Ni(CO)4(g)中断开了金属键,形成了配位键;②Ni(CO)4(g)
Ni(CO)4(g)中断开了金属键,形成了配位键;②Ni(CO)4(g)![]() Ni(S)+4CO(g)中断开了配位键,形成了金属键,故选BD;
Ni(S)+4CO(g)中断开了配位键,形成了金属键,故选BD;
(2)非金属性越强,气态氢化物越稳定,非金属性O>C,则最简单气态氢化物的稳定性H2O>CH4,故答案为:H2O>CH4;
(3)非金属性越强,电负性越强,非金属性O>C>Ni,所以电负性由大到小的顺序是O>C>Ni,故答案为:O>C>Ni;
(4)化合物Ni(CO)4呈正四面体构型,中心原子Ni形成4个配位键,则Ni(CO)4中Ni原子的杂化类型为sp3杂化,故答案为:sp3杂化;
(5)Ni是28号元素,其核外电子排布式为:1s22s22p43s23p43d84s2,其外围电子排布式为3d84s2,价电子的轨道表示式为 ,故答案为:3d84s2;
,故答案为:3d84s2; ;
;
(6)NiO和FeO晶体结构类型与氯化钠的相同,均为离子晶体,Ni2+和Fe2+电荷数相同,离子半径越小,晶格能越大,熔点越高,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,所以熔点NiO>FeO,故答案为:>。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]()
![]() 2Z(g)此反应达到平衡的标志是( )
2Z(g)此反应达到平衡的标志是( )
A. 容器内压强不随时间变化
B. 容器内气体的密度不随时间变化
C. 容器内X、Y、Z的浓度之比为1︰2︰2
D. 单位时间消耗0.1mol X同时生成0.2mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸锌作为补锌药,具有见效快、吸收率高、副作用小、使用方便等优点。某学习小组在实验室以葡萄糖和氧化锌为主要原料合成该物质。
反应原理:CH2OH(CHOH)4CHO + H2O2 ![]() CH2OH(CHOH)4COOH + H2O
CH2OH(CHOH)4COOH + H2O
2CH2OH(CHOH)4COOH + ZnO ![]() Zn[CH2OH(CHOH)4COO] 2 + H2O
Zn[CH2OH(CHOH)4COO] 2 + H2O
设计的合成路线为:
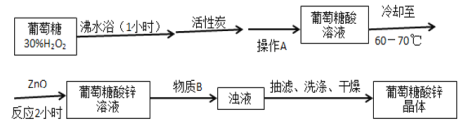
相关信息如下:
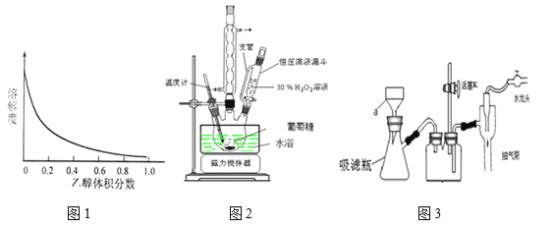
葡萄糖酸锌易溶于水,在乙醇与水的混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图1
实验中所涉及的部分装置如图所示(图2装置先制备葡萄糖酸,再与ZnO反应制备
葡萄糖酸锌),图3为抽滤装置
请根据以上信息,回答下列问题:
(1)图2中恒压滴液漏斗的支管的作用是___________,图3中a装置的名称____________。
(2)30%H2O2所用的物质的量大概是葡萄糖的3倍,而且并未一次性与葡萄糖混合,而是利用恒压滴液漏斗缓慢滴加的理由_________________________________。
(3)操作A是______________,物质B是________________。
(4)抽滤完毕或中途停止抽滤时,应先___________________,然后____________________。
(5)三颈烧瓶中的葡萄糖酸锌晶体转入到抽滤装置中时,瓶壁上往往还粘有少量晶体,需选用液体将瓶壁上的晶体冲洗下来后转入到抽滤装置中,下列液体最合适的是_______。
A 无水乙醇 B 饱和NaCl溶液 C 70%乙醇水溶液 D 滤液
(6)下列说法正确的是________。
A 用银氨溶液来替代30%H2O2将葡萄糖转变成葡萄糖酸,既经济又方便
B ZnO粉末与葡萄糖酸反应时,利用磁力搅拌可以增大ZnO粉末与葡萄糖酸的接触面积,加快反应速率
C 在抽滤过程中,如果吸滤瓶中的液体快接近支管口时,则拔掉吸滤瓶上的橡皮管,并从吸滤瓶的支管口倒出溶液
D 将葡萄糖酸锌晶体放在干燥器中可以防潮,在干燥器中放有干燥剂,并添加了无水CoCl2来指示是否得更换干燥剂,如果CoCl2为蓝色,说明干燥剂已经失效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂电池由于能量密度大逐渐取代锌电池。常用锂电池的正极材料为磷酸亚铁锂(LiFe-PO4),可采用FeCl3、NH4H2PO4、LiCl和苯胺等原料制备。回答下列问题:
(1)Fe基态原子核外电子排布式为___。
(2)已知Li2O是离子晶体,其晶格能的Born-Haber循环如图所示。
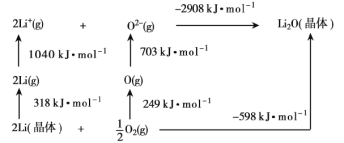
如图可知,Li原子的第一电离能为___kJ·mol-1,O=O键键能为___kJ·mol-1,Li2O晶格能为__kJ·moL-1。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___,其中Fe的配位数为___。
(4)NH4H2PO4中,P的杂化轨道类型为___。
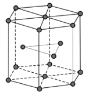
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为___。六棱柱底边边长为a cm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为___g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列有关反应的叙述错误的是( )
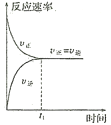
A.开始反应时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大
C.反应到达![]() 时,正反应速率与逆反应速率相等,反应停止
时,正反应速率与逆反应速率相等,反应停止
D.反应在![]() 之后,正反应速率与逆反应速率相等,反应达到化学平衡状态
之后,正反应速率与逆反应速率相等,反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用固体表面催化工艺进行NO分解的过程如下图所示。
![]()
下列说法不正确的是
A.NO属于共价化合物
B.O2含有非极性共价键
C.过程②吸收能量,过程③释放能量
D.标准状况下,NO分解生成11.2LN2转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种碳骨架如下的烃。下列说法正确的是( )
![]()
①a和d是同分异构体 ②b和c是同系物 ③a和d都能发生加聚反应 ④只有b和c能发生取代反应
A. ①② B. ①④
C. ②③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 48gO3气体含有6.02×1023个O3分子
B. 常温常压下,4.6gNO2气体含有1.81×1023个NO2分子
C. 0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D. 标准状况下,33.6LH2O含有9.03×1023个H2O分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下:C6H5-CH3+2KMnO4![]() C6H5-COOK+KOH+2MnO2↓+H2O,C6H5-COOK+HCl→C6H5-COOH+KCl
C6H5-COOK+KOH+2MnO2↓+H2O,C6H5-COOK+HCl→C6H5-COOH+KCl
已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3g和6.9g。
(制备产品)30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在80℃下反应30min,装置如图所示:

(1)图中支管的作用是______
(2)相对于用酒精灯直接加热,用沸水浴加热的优点是_____,在本实验中,三颈烧瓶最合适的容积是_____(填字母)
A.50mL B.100mL C.200mL D.250mL
(分离产品)他们设计如下流程分离粗产品苯甲酸和回收甲苯:

(3)操作Ⅰ的名称是____;含杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是_____
(4)操作Ⅲ的名称是_____、____检验B中是否含有Cl-的方法如下:取少量B溶于水,在上层清液中滴加稀硝酸酸化的_____溶液,若产生白色沉淀,则B中含有Cl-。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com