
【题目】氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1)基态磷原子有________种不同能量的电子。
(2)N、P、As电负性由大到小的顺序为 ______ ,它们的氢化物沸点最高的为_______________,原因为___________________________。
(3)NO3- 离子的空间构型为_____,中心原子的杂化方式为_____ ,NO3-离子有多种等电子体,请写出一种_________ 。
(4)钛元素原子核外价电子排布图为____________,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型为____________,该配离子的配位数为____________。
(5)砷化镓晶胞结构如下图。晶胞中距离Ga原子等距且最近的Ga原子有_________个,Ga与周围等距且最近的As形成的空间构型为____________。已知砷化镓晶胞边长为a pm,其密度为ρgcm-3,则阿伏加德罗常数的数值为_____________(列出计算式即可)。
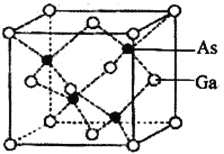
【答案】 5 N>P>As NH3 NH3分子间形成氢键 平面正三角形 sp2 CO32-(SO3、BF3等) ![]() 共价键、配位键 6 12 正四面体
共价键、配位键 6 12 正四面体 ![]() (或
(或![]() )
)
【解析】(1)基态磷原子的电子排布式为:1s22s22p63s23p3,有5个能级,有5种不同能量的电子;(2)同主族元素原子从上而下电负性逐渐减小,则N、P、As电负性由大到小的顺序为N>P>As,它们的氢化物沸点最高的为NH3,因为NH3分子间形成氢键;(3)N原子形成3个δ键,孤对电子数=![]() =0,所以中心原子为sp2杂化,立体构型为平面正三角形;原子总数相同、价电子总数相同的粒子互称为等电子体。NO3-离子原子总数为4,价电子总数24,符合条件的等电子体有CO32-、SO3、BF3等;(4)Ti是22号元素,核外电子排布式为1s22s22p63s23p63d24s2,价电子排布式为为3d24s2,核外价电子排布图为
=0,所以中心原子为sp2杂化,立体构型为平面正三角形;原子总数相同、价电子总数相同的粒子互称为等电子体。NO3-离子原子总数为4,价电子总数24,符合条件的等电子体有CO32-、SO3、BF3等;(4)Ti是22号元素,核外电子排布式为1s22s22p63s23p63d24s2,价电子排布式为为3d24s2,核外价电子排布图为![]() ;配合物[TiCl(H2O)5]Cl2·H2O的配离子中含有的化学键类型为共价键、配位键,配离子[TiCl(H2O)5]2+的中心离子所带的电荷2+1=3,故中心离子为Ti3+,Cl-、H2O含有孤对电子对是配体,配位数是6;(5)Ga原子处于晶胞的顶点和面心,面心到顶点和到相邻面心的距离最小且相等,根据图可知为4×3=12个,Ga与周围等距且最近的As形成的空间构型为Ga在中心As在四个顶点形成的正四面体结构;GaAs为1:1型结构,一个晶胞占有4个Ga原子和4个As原子,若晶胞的边长为a pm,则晶胞体积为(a×10-10)3cm3,晶体的密度为ρg/cm3,则晶胞质量为(a×10-10)3cm3×ρg/cm3=ρa3×10-30 g,则ρa3×10-30g×NA=4×145g/mol,则NA=
;配合物[TiCl(H2O)5]Cl2·H2O的配离子中含有的化学键类型为共价键、配位键,配离子[TiCl(H2O)5]2+的中心离子所带的电荷2+1=3,故中心离子为Ti3+,Cl-、H2O含有孤对电子对是配体,配位数是6;(5)Ga原子处于晶胞的顶点和面心,面心到顶点和到相邻面心的距离最小且相等,根据图可知为4×3=12个,Ga与周围等距且最近的As形成的空间构型为Ga在中心As在四个顶点形成的正四面体结构;GaAs为1:1型结构,一个晶胞占有4个Ga原子和4个As原子,若晶胞的边长为a pm,则晶胞体积为(a×10-10)3cm3,晶体的密度为ρg/cm3,则晶胞质量为(a×10-10)3cm3×ρg/cm3=ρa3×10-30 g,则ρa3×10-30g×NA=4×145g/mol,则NA=![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,书写正确的是( )
A. 氢氧化铜与稀硫酸反应:OH-+H+===H2O
B. 铁粉加入稀硫酸中:2Fe+6H+===2Fe3++3H2↑
C. 碳酸钙与醋酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
D. 氯化铝溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示,下列有关说法不正确的是

A. X分子中含有三种官能团
B. 可用酸性高锰酸钾溶液区别苯和X
C. X在一定条件下能发生加成、加聚、取代、氧化等反应
D. 在催化剂的作用下,1 mol X最多能与5 mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸厂烧渣(主要成分是Fe2O3,其次含少量的SiO2和FeS)经回收处理可制得绿矾(FeSO4·7H2O)和一种重要的水处理剂聚铁胶体[Fe(OH)SO4]n,上述生产工艺流程如下:

请通过分析回答下列相关问题:
(1)操作Ⅰ的名称是 _____。
(2)灼烧产生的尾气对大气有污染,因此工业生产中必须进行回收处理,下列方法可行的是____________。
A.直接用水吸收 B. 用氨水吸收
C. 用浓硫酸吸收 D. 与空气混合用石灰石粉末悬浊液吸收
(3)操作Ⅲ经蒸发浓缩、___________、过滤、____、干燥等。
(4)在由溶液X制聚铁胶体过程中①调节pH及②控制温度目的是_________。
(5)检验溶液X中金属阳离子所加试剂是______,其现象是___________ 。
(6)溶液X转化为溶液Y需加入一种常见物质是 ____________ 。
(7)在反应釜中FeS、O2及稀H2SO4反应生成硫酸铁等物质,则反应的离子方程式是________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式书写正确的是( )
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.金属铜投入硝酸银溶液中:Cu+Ag+=Cu2++Ag
C氢氧化铜固体投入稀硝酸:Cu(OH)2+2H+=Cu2++2H2O
D.石灰石溶于醋酸:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:

(1)“O”点导电能力为0的理由是___________________ ;
(2)a、b、c三点溶液的pH由小到大的顺序为___;
(3)a、b、c三点溶液中CH3COO物质的量最大的是___;
(4)若使c点溶液中c(CH3COO)增大,溶液的pH也增大,可采取得措施是(写出两种方法):__________________、_________________________________
(5)现有pH均为3的醋酸、硫酸两瓶溶液:
a.设两种溶液的物质的量浓度依次为c1、c2,则其关系式 ___________(用<,>,= 表示,下同)
b.取相同体积的两种酸分别加入等体积的蒸馏水后,再分别加入等量的锌粉,反应开始时放出氢气的速率依次为v1、v2,则其关系式_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和滴定是化学定量实验之一。某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是__________________。(写序号)
(2)选用的指示剂是 。(a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处。
滴定次数 | 待测氢氧化钠溶液的体积/ mL | 0.1000 mol/L 盐酸的体积/ mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/ mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
(7)滴定终点的判定依据是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与盐类水解无关的是( )
A.氯化铝溶液蒸干后灼烧得不到无水氯化铝
B.氯化铁溶液常用作制印刷电路板的腐蚀剂
C.常用热的纯碱溶液除去油污
D.长期施用硫酸铵易使土壤酸化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com