
【题目】有关下列装置或操作说法正确的是
A.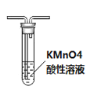 中:可以除去甲烷中混有的乙烯
中:可以除去甲烷中混有的乙烯
B. 中:装置可用于证明非金属性强弱:Si<C<Cl
中:装置可用于证明非金属性强弱:Si<C<Cl
C. 中:可用于制备、收集乙酸乙酯
中:可用于制备、收集乙酸乙酯
D.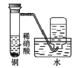 中:制备并收集少量NO2气体
中:制备并收集少量NO2气体
科目:高中化学 来源: 题型:
【题目】![]() 是广泛用于橡胶工业的硫化剂,常温下
是广泛用于橡胶工业的硫化剂,常温下![]() 是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构与
是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构与![]() 类似
类似![]() 下列说法错误的是
下列说法错误的是![]()
A. ![]() 分子中的两个S原子均是
分子中的两个S原子均是![]() 杂化
杂化
B. ![]() 与
与![]() 反应的化学方程式可能为:
反应的化学方程式可能为:![]()
C. ![]() 与
与![]() 结构相似,熔沸点
结构相似,熔沸点![]()
D. ![]() 分子中的S为
分子中的S为![]() 价,是含有极性键和非极性键的非极性分子
价,是含有极性键和非极性键的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CsF是离子晶体,其晶格能可通过下图的循环计算得到,以下说法错误的是
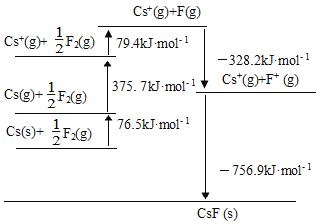
A. Cs原子的第一电离能为452.2 kJ·mol1
B. F-F键的键能为158.8 kJ·mol1
C. CsF的晶格能756.9kJ·mol1
D. 1molCs(s)转变成Cs(g)所要吸收的能量为76.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 1 molN2与4molH2混合充分反应,则转移的电子数目为6mol
B. 向0.1mol·L-1CH3COONa溶液中加入少量水,溶液中![]() 减小
减小
C. 常温下,C(s)+H2O(g)![]() CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
D. HCl和NaOH反应的中和热为-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热为-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Ⅰ~Ⅳ四个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
容器 | 起始时 | ||
t/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
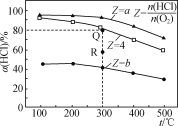
A. ΔH<0,a<4<b
B. 300℃该反应的平衡常数的值为64
C. 容器Ⅲ某时刻处在R点,则R点的υ正>υ逆,压强:p(R)>p(Q)
D. 若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要的精细化学品M和N,常用作交联剂、涂料、杀虫剂等,合成路线如图1所示:
图1:
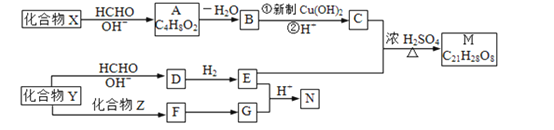
已知:i、-CHO+![]()
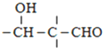
ii、RCHO+![]()
![]()
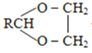 +H2O
+H2O
iii、N的结构简式是
请回答下列问题:
(1)A中含氧官能团名称是______________,由A生成B的反应类型是___________。
(2)写出下列物质的结构简式:X:_________Z:______________E:______
(3)C和甲醇反应的产物可以聚合形成有机玻璃,该聚合反应的化学方程式是:____。
(4)G中碳原子________(填“一定”、“不一定”或“一定不”)在同一平面内;1mol G一定条件下,最多能与________mol H2发生反应;与G含有相同官能团的同分异构体(不包含G)有___________种。
(5)由Y生成D的化学方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中氮氧化物和碳氢化合物受紫外线作用可产生一次污染物——光化学烟雾,其中部分物质的反应过程如图所示。下列说法正确的是( )

A.该过程中![]() 作催化剂B.反应过程中没有电子转移
作催化剂B.反应过程中没有电子转移
C.反应过程中氮氧化物不断被消耗D.丙烯转化为甲醛和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
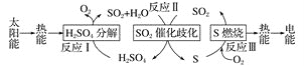
(1)反应Ⅰ:2H2SO4(l)===2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)===SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:_________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2___p1(填“>”或“<”),得出该结论的理由是____。

(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
ⅰ.SO2+4I-+4H+===S↓+2I2+2H2O
ⅱ.I2+2H2O+_____===_____+____+2I-
(4)探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mLSO2饱和溶液加入2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
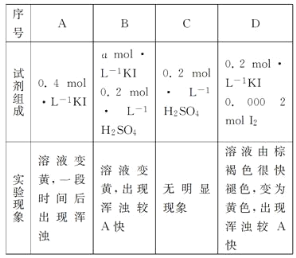
①B是A的对比实验,则a=_____。
②比较A、B、C,可得出的结论是_______。
③实验表明,SO2的歧化反应速率D>A。结合ⅰ、ⅱ反应速率解释原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca + 2Cl--2e- = CaCl2
B. 放电过程中,Li+向负极移动
C. 没转移0.1mol电子,理论上生成20.7 g Pb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com