
����Ŀ����������ʮ�����ʣ���H2���� ��CaO ��CO2��H2SO4��Ba��OH��2�ߺ��ɫ����������Һ�� �ఱˮ ��ϡ���� ��Al2��SO4��3
��1������ʮ������������������֮��ɷ������ӷ�Ӧ��H++OH���TH2O�������ӷ�Ӧ��Ӧ�Ļ�ѧ����ʽΪ ��
��2������ˮ�еĵ��뷽��ʽΪ ��
��3�������Ģ�ͨ�����Һ�з�Ӧ�����ӷ���ʽΪ �� �����Ģ�ͨ�����Һ�з�Ӧ�����ӷ���ʽΪ ��
��4�����������̼��������Һ��Ӧ���ӷ���ʽ�� ��
��5������ᷢ����Ӧ�Ļ�ѧ����ʽΪ��Al+4HNO3=Al��NO3��3+NO��+2H2O������5.4g Al������Ӧʱ��ת�Ƶ��ӵ���ĿΪ ��
���𰸡�
��1��Ba��OH��2+2HNO3=Ba��NO3��2+2H2O
��2��Al2��SO4��3=2Al3++3SO42��
��3��CO2+Ba2++2OH��=BaCO3��+H2O,CO2+OH��=HCO3��
��4��Ba2++2OH+2HCO3��=2H2O+BaCO3��+CO32��
��5��0.6NA��3.612��1023
���������⣺��1������ʮ������������������֮��ɷ������ӷ�Ӧ��H++OH��=H2O��˵����ǿ��ǿ�Ӧ��������ˮ���ε����ӷ�Ӧ������������ϡ���ᷴӦ���ϣ������ӷ�Ӧ��Ӧ�Ļ�ѧ����ʽΪBa��OH��2+2HNO3=Ba��NO3��2+2H2O��
��2��Al2��SO4��3��������ǿ����ʣ�ˮ��Һ����ȫ���룬���뷽��ʽΪ��Al2��SO4��3=2Al3++3SO42����
��3�������Ģ�ͨ�����Һ�з�Ӧ���Ƕ�����̼ͨ������������Һ�з�Ӧ����̼�ᱵ������ˮ����Ӧ�����ӷ���ʽΪCO2+Ba2++2OH��=BaCO3��+H2O�������Ģ�ͨ�����Һ�з�Ӧ�����ӷ���ʽΪCO2+OH��=HCO3����
��4�����������̼��������Һ��Ӧ����̼�ᱵ��̼���ƺ�ˮ�����ӷ�ӦΪBa2++2OH+2HCO3��=2H2O+BaCO3��+CO32����
��5������ᷢ����Ӧ�Ļ�ѧ����ʽΪ��Al+4HNO3=Al��NO3��3+NO��+2H2O������5.4g Al���ʵ���= ![]() =0.2mol������ת��Ϊ0.2mol����3��0��=0.6mol��������Ϊ0.6NA��3.612��1023��
=0.2mol������ת��Ϊ0.2mol����3��0��=0.6mol��������Ϊ0.6NA��3.612��1023��
���Դ��ǣ���1��Ba��OH��2+2HNO3=Ba��NO3��2+2H2O����2��Al2��SO4��3=2Al3++3SO42������3��CO2+Ba2++2OH��=BaCO3��+H2O��CO2+OH��=HCO3������4��Ba2++2OH+2HCO3��=2H2O+BaCO3��+CO32������5��0.6NA��3.612��1023��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�������HCl���壬��������100mLϡ�����У�������Һ��������䣬������Һ�м���4molL��1��NaOH��Һ10mLǡ�ó����ԣ�����������������Һ�е��������Ba��OH��2��Һ�����ó�������Ϊ2.33g��
��1�����ɳ����Ļ�ѧ����ʽΪ�� ��
��2����������ʵ���Ũ�ȣ�c��H2SO4��= ��
��3����HCl�����ڱ�״���µ����ΪmL��
��4������û�����Һ����Ϊ100mL���м���Na2CO310H2O���壬ֱ�����ٲ�������ʱΪֹ������Na2CO310H2O���������Ϊg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A. Ư���е���Ч�ɷ�Ϊ������ƣ��ڿ����п��Գ�ʱ����ö�������
B.���������ǽ�̫����ת��Ϊ���ܵij��ò���
C.����ŦԼ�������й�ůʹ�õ���Ҫ��Դ����Ȼ������Ȼ�����ڲ���������Դ
D.�����������õ��˴�������ʯ�ң�����ʯ��Ͷ�����̳صĺ�ˮ�У���ˮ��ʼ���ڣ�����һ�������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�ﵽ��ѧƽ��ı�־��
A. �淴Ӧֹͣ����B. ��Ӧ�����������Ũ�����
C. ����Ӧ���淴Ӧֹͣ����D. ����Ӧ���ʺ��淴Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ�ѧ��Ӧ�е������仯������ȷ����
A. �γ��»�ѧ���Ĺ��̻�ų�����B. �кͷ�Ӧ�����ȷ�Ӧ
C. ���Ȳ��ܷ����ķ�Ӧ�����ȷ�ӦD. ����CO2�ķ�Ӧ�Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ԫ�����ڱ���˵������ȷ����
A. Ԫ�����ڱ���8������
B. ��A���Ԫ��ȫ���ǽ���Ԫ��
C. Ԫ�����ڱ���7������
D. ��������ָ��1��2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ���ѧʽΪFeOOH����һ�ֻ�ɫ���ϣ���ҵ���÷���Ϊ��Ҫԭ�������������Ƶ�һ�ֹ����������£�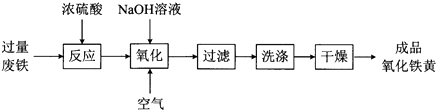
��1��������������Ԫ�صĻ��ϼ�Ϊ �� �����ڷ�Ӧǰ�����ȵĴ�����Һ��ϴ�������ۣ���ԭ������д���ӷ���ʽ����
��2���������������������ƵĻ�ѧ����ʽ�� ��
��3�����������У����顰ϴ�ӡ��Ƿ���ȫ�ķ����� ��
��4������ʱӦ����pH�ĺ�����Χ��3.5��4.0��pH��С�����������Ʋ��ʽϵ͵Ŀ���ԭ���� ��
��5��ȡ1g��Ʒ���д��Ȳ��ԣ������ܽ�������ϡ�����У�����һ��Ũ�ȵĹ���NaOH��Һ�������е���Ԫ�أ��õ�����������ΪBg�������������������Ʒ�Ĵ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п���仯������;�㷺������п����п����Ҫ�ɷ���ZnS��Ϊ��Ҫԭ�ϣ��漰����Ҫ��Ӧ�У�
2ZnS��s��+3O2��g���T2ZnO��s��+2SO2��g����H1=��930kJmol��1
2C��s��+O2��g���T2CO��g����H2=��221kJmol��1
ZnO��s��+CO��g���TZn��g��+CO2��g����H3=198kJmol��1
��1����ӦZnS��s��+C��s��+2O2��g���TZn��g��+CO2��g��+SO2��g���ġ�H4=kJmol��1 ��
��2����Ӧ�����ɵ�CO2��NH3��ϣ���һ�������·�Ӧ�ϳ����أ�2NH3��g��+CO2��g�� ![]() CO��NH2��2��s��+H2O��g��
CO��NH2��2��s��+H2O��g��
��H��0�����÷�Ӧ��һ���¡������ܱ������ڽ��У��жϷ�Ӧ�ﵽƽ��״̬�ı�־��
a��CO2��H2O��g��Ũ����� b�������������ѹǿ���ٸı�
c��2v��NH3����=v��H2O���� d�������л��������ܶȲ��ٸı�
������߰�����ת���ʣ����Բ�ȡ�Ĵ�ʩ����д��������
��3������п�ɹ㷺����ӡȾýȾ����ľ�ķ�������ZnSO4���ȷֽ�����и��������ʵ������¶ȱ仯��ϵ��ͼ1��ʾ�� 
��700�桫980��ʱ������Ӧ���������ʶ�������ZnO����������÷�Ӧ��2L�ܱ������ڽ��У�10minʱ��������ɵ����������ʵ���Ϊ0.3mol�������ʱ������������������Ϊ
������п�ֽ����ɵ�SO2��ͼ2�е�ѭ���ɵõ�H2SO4 �� ѭ���е�����������Ӧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�ͨ��������Ϊ�ж�����Ԫ�طǽ�����ǿ�������ݵ��ǣ� ��
A. ����̬�⻯����ȶ���B. ���ʵ������Ե�ǿ��
C. ������������Ӧ��ˮ���������D. ���ʵ��۵�ߵ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com