
【题目】锌及其化合物用途广泛.火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:
2ZnS(s)+3O2(g)═2ZnO(s)+2SO2(g)△H1=﹣930kJmol﹣1
2C(s)+O2(g)═2CO(g)△H2=﹣221kJmol﹣1
ZnO(s)+CO(g)═Zn(g)+CO2(g)△H3=198kJmol﹣1
(1)反应ZnS(s)+C(s)+2O2(g)═Zn(g)+CO2(g)+SO2(g)的△H4=kJmol﹣1 .
(2)反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
△H<0,若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆 d.容器中混合气体的密度不再改变
若想提高氨气的转化率,可以采取的措施有(写出两条)
(3)硫酸锌可广泛用作印染媒染剂和木材防腐剂.ZnSO4受热分解过程中各物质物质的量随温度变化关系如图1所示. 
①700℃~980℃时发生反应中生成物质二氧化硫、ZnO和氧气,如该反应在2L密闭容器内进行,10min时,测得生成的氧气的物质的量为0.3mol,则这段时间二氧化硫的生成速率为
②硫酸锌分解生成的SO2经图2中的循环可得到H2SO4 . 循环中电解过程阳极反应式是 .
【答案】
(1)﹣377.5
(2)bd;增大压强,适当降低温度等
(3)0.03mol/(L.min);Mn2+﹣2e﹣+2H2O=MnO2+4H+
【解析】解:(1)①2ZnS(s)+3O2(g)═2ZnO(s)+2SO2(g)△H1=﹣930kJmol﹣1②2C(s)+O2(g)═2CO(g)△H2=﹣221kJmol﹣1③ZnO(s)+CO(g)═Zn(g)+CO2(g)△H3=198kJmol﹣1将方程式 ![]() +③得ZnS(s)+C(s)+2O2(g)═Zn(g)+CO2(g)+SO2(g),△H4=
+③得ZnS(s)+C(s)+2O2(g)═Zn(g)+CO2(g)+SO2(g),△H4= ![]() +198kJ/mol=﹣377.5kJ/mol;
+198kJ/mol=﹣377.5kJ/mol;
所以答案是:﹣377.5;
(2.)2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g)△H<0,反应是气体体积减小的放热反应,a.CO2与H2O(g)浓度相等,正逆反应速率不一定相等,所以不一定达到平衡状态,故a错误;b.该反应前后气体物质的量减少,当容器中气体的压强不再改变时正逆反应速率相等,反应达到平衡状态,故b正确;c.当v(NH3)正=2v(H2O)逆时该反应达到平衡状态,所以当2v(NH3)正=v(H2O)逆时该反应没有达到平衡状态,故c错误;d.反应前后问题密度改变,所以当容器中混合气体的密度不再改变时该反应达到平衡状态,故d正确;反应是气体体积减小的放热反应,若想提高氨气的转化率,可以采取的措施有增大压强、降低温度等是平衡正向进行,所以答案是:bd;增大压强,适当降低温度等;
CO(NH2)2(s)+H2O(g)△H<0,反应是气体体积减小的放热反应,a.CO2与H2O(g)浓度相等,正逆反应速率不一定相等,所以不一定达到平衡状态,故a错误;b.该反应前后气体物质的量减少,当容器中气体的压强不再改变时正逆反应速率相等,反应达到平衡状态,故b正确;c.当v(NH3)正=2v(H2O)逆时该反应达到平衡状态,所以当2v(NH3)正=v(H2O)逆时该反应没有达到平衡状态,故c错误;d.反应前后问题密度改变,所以当容器中混合气体的密度不再改变时该反应达到平衡状态,故d正确;反应是气体体积减小的放热反应,若想提高氨气的转化率,可以采取的措施有增大压强、降低温度等是平衡正向进行,所以答案是:bd;增大压强,适当降低温度等;
(3.)①700℃~980℃时发生反应时,根据图知,生成ZnO、氧气和B,根据元素守恒知,B中含有S元素,因为生成氧气失电子,则S元素应该得电子发生还原反应,所以B应该是SO2 , 根据反应物和生成物及反应条件书写方程式为2ZnSO4 ![]() 2ZnO+2SO2↑+O2↑,如该反应在2L密闭容器内进行,10min时,测得生成的氧气的物质的量为0.3mol,V(O2)=
2ZnO+2SO2↑+O2↑,如该反应在2L密闭容器内进行,10min时,测得生成的氧气的物质的量为0.3mol,V(O2)= ![]() =0.015mol/Lmin,反应速率之比等于化学方程式计量数之比,V(SO2)=2V(O2)=0.03mol/(L.min),所以答案是:0.03mol/(L.min);②电解硫酸锰时,生成二氧化锰和硫酸,阳极上失电子发生氧化反应,电极反应式为Mn2+﹣2e﹣+2H2O=MnO2+4H+ ,
=0.015mol/Lmin,反应速率之比等于化学方程式计量数之比,V(SO2)=2V(O2)=0.03mol/(L.min),所以答案是:0.03mol/(L.min);②电解硫酸锰时,生成二氧化锰和硫酸,阳极上失电子发生氧化反应,电极反应式为Mn2+﹣2e﹣+2H2O=MnO2+4H+ ,
所以答案是:Mn2+﹣2e﹣+2H2O=MnO2+4H+ .
【考点精析】掌握化学平衡状态本质及特征和化学平衡状态的判断是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】已知:(X代表卤素原子,R代表烃基) 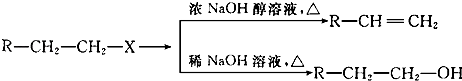
利用上述信息,按以下步骤从 ![]() 合成
合成 ![]() .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)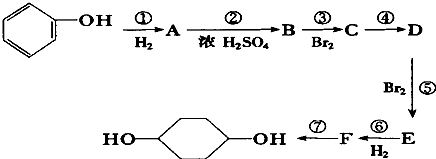
请回答下列问题:
(1)分别写出B、D的结构简式:B_、D .
(2)反应①~⑦中属于消去反应的是 . (填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为: .
(4)试写出C→D反应的化学方程式(有机物写结构简式,并注明反应条件): .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①H2②铝 ③CaO ④CO2⑤H2SO4⑥Ba(OH)2⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为 .
(2)⑩在水中的电离方程式为 .
(3)少量的④通入⑥的溶液中反应的离子方程式为 , 过量的④通入⑥的溶液中反应的离子方程式为 .
(4)⑥与过量的碳酸氢钠溶液反应离子方程式: .
(5)②与⑨发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,当有5.4g Al发生反应时,转移电子的数目为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量.a中试剂是浓氨水. 
(1)仪器a的名称为 , 仪器b中装入的试剂可以是 .
(2)按气流方向正确的装置连接顺序为(填序号,装置可重复使用): .
(3)装置C的作用: .
(4)实验结束时,应首先(填序号); 这样做的原因是 . Ⅰ.熄灭A装置的酒精灯Ⅱ.停止从a中滴加液体
(5)若金属氧化物为CuO,反应的化学方程式为
(6)若实验中准确称取金属氧化物的质量为m g,完全反应后,测得生成水的质量为n g,则M的相对原子质量为(用含x、y、m、n的式子表示).
(7)某同学仔细分析上述装置后认为仍存在缺陷,你认为该如何改进? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应N2+3H22NH3 , △H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图1所示: 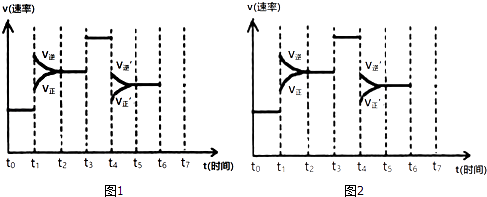
回答下列问题:
(1)处于平衡状态的时间段是(填选项).
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是:t1时刻;t3时刻;t4时刻 . (填选项).
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
(3)依据(2)中结论,下列时间段中,氨的百分含量最高的是(填选项).
A.t0~t1
B.t2~t3
C.t3~t4
D.t5~t6
(4)一定条件下,合成氨反应达到平衡时,若将密闭容器体积缩小一半,则对反应产生的影响是(填选项).
A.正反应速率减小,逆反应速率增大
B.正反应速率增大,逆反应速率减小
C.正、逆反应速率都减小
D.正、逆反应速率都增大
(5)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图2中画出反应速率的变化曲线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是( ) 
A.洗气瓶中产生的沉淀是碳酸钡
B.从Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是亚硫酸钡
D.在Z导管口有红棕色气体出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用芳香烃X和烯烃Y可以合成紫外线吸收剂BAD,BAD的结构简式为: 
已知G不能发生银镜反应.BAD的合成路线如下:
试回答下列问题
(1)写出结构简式:D .
(2)属于取代反应的有(填数字序号).
(3)1mol BAD最多可与含mol NaOH的溶液完全反应.
(4)写出下列反应的化学方程式:
反应④:
反应⑤: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com