
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下: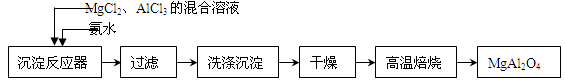
⑴制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
⑵如图所示,过滤操作中的一处错误是 。判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。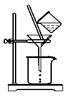
⑶在25℃下,向浓度均为0.01 mol?L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成_______沉淀(填化学式),生成该沉淀的离子方程式_______ ______________
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10 -34。)
⑷无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。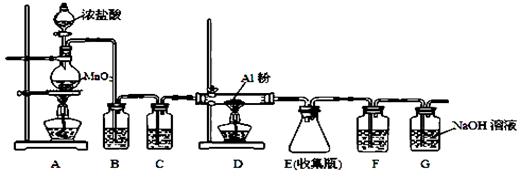
装置B中盛放饱和NaCl溶液,该装置的主要作用是 ; F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
⑸将Mg、Cu组成的3.92g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792L(标准状况),向反应后的溶液中加入4mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
(1) 2 Al(OH)3+Mg (OH)2 MgAl2O4 + 4H2O
MgAl2O4 + 4H2O
(2)漏斗下端尖嘴未紧贴烧杯内壁 AgNO3溶液(或硝酸酸化的AgNO3溶液);坩埚
(3)Al(OH)3 Al3++ 3NH3·H2O=Al(OH)3↓+ 3NH4+
(4)除去HCl;吸收水蒸气;碱石灰(或NaOH与CaO混合物)
(5)8.00
解析
试题分析:(1)向MgCl2、AlCl3的混合溶液中加入过量的氨水,发生反应:MgCl2+ 2NH3·H2O=Mg(OH)2↓+ 2NH4Cl;AlCl3+ 3NH3·H2O=Al(OH)3↓+ 3NH4Cl;然后把Al(OH)3、Mg (OH)2沉淀过滤出来,并洗涤干净、干燥,最后高温灼烧发生反应2Al(OH)3+Mg (OH)2 MgAl2O4 + 4H2O。即得到要制备MgAl2O4。⑵在如图所示的过滤操作中的错误是漏斗下端尖嘴未紧贴烧杯内壁。由于沉淀是从金属氯化物中过滤出来的,所以要判断流程中沉淀是否洗净的方法就是用硝酸酸化的AgNO3溶液来检验是否含有Cl-即可。高温焙烧时,要用坩埚来盛放固体物质。⑶Mg2+形成沉淀需要的
MgAl2O4 + 4H2O。即得到要制备MgAl2O4。⑵在如图所示的过滤操作中的错误是漏斗下端尖嘴未紧贴烧杯内壁。由于沉淀是从金属氯化物中过滤出来的,所以要判断流程中沉淀是否洗净的方法就是用硝酸酸化的AgNO3溶液来检验是否含有Cl-即可。高温焙烧时,要用坩埚来盛放固体物质。⑶Mg2+形成沉淀需要的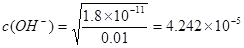 ;而Al3+形成沉淀需要的
;而Al3+形成沉淀需要的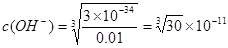 <4.242×10-5。需要的OH-的浓度越小,越容易形成沉淀。因此首先形成的是Al(OH)3沉淀。(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是除去氯气中杂质气体HCl,同时减小氯气的溶解。由于无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,所以在F中试剂的作用是吸收水蒸气,防止无水AlCl3水解。用干燥管装填碱石灰也可起到F和G的作用。⑸Mg、Cu与硝酸发生反应变为Mg2+、Al3+时失去的电子的物质的量与HNO3得到电子的物质的量相等。而当向反应后的溶液中加入NaOH溶液金属离子恰好完全沉淀时增加的质量就是OH-的质量,其物质的量就等于Mg2+、Al3+时失去的电子的物质的量。根据等量关系可得。n(NO)= 1.792L÷22.4L/mol=0.08mol.所以n(e-)="0.08mol×3=0.24mol." 故形成沉淀的质量为3.92g+0.24mol×17g/mol=8.00g。
<4.242×10-5。需要的OH-的浓度越小,越容易形成沉淀。因此首先形成的是Al(OH)3沉淀。(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是除去氯气中杂质气体HCl,同时减小氯气的溶解。由于无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,所以在F中试剂的作用是吸收水蒸气,防止无水AlCl3水解。用干燥管装填碱石灰也可起到F和G的作用。⑸Mg、Cu与硝酸发生反应变为Mg2+、Al3+时失去的电子的物质的量与HNO3得到电子的物质的量相等。而当向反应后的溶液中加入NaOH溶液金属离子恰好完全沉淀时增加的质量就是OH-的质量,其物质的量就等于Mg2+、Al3+时失去的电子的物质的量。根据等量关系可得。n(NO)= 1.792L÷22.4L/mol=0.08mol.所以n(e-)="0.08mol×3=0.24mol." 故形成沉淀的质量为3.92g+0.24mol×17g/mol=8.00g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
电解饱和食盐水的反应为2NaCl+2H2O Cl2↑+H2↑+2NaOH。
Cl2↑+H2↑+2NaOH。
27. 在上述方程式上标出电子转移的方向和数目。
28. 该反应中被氧化的元素是 。阴极产物之一为H2,阴极上发生的变化为 反应(选填“氧化”、“还原”)。
29. 电解产物氯气既能作氧化剂,也能作还原剂。下列反应中氯气只作氧化剂的是 (填写编号)。
a.Cl2+2KI→2KCl+I2 b.Cl2 + 2NaOH →NaCl + NaClO + H2O
c.CuCl2 Cl2↑+ Cu d.3Cl2 + 2Fe
Cl2↑+ Cu d.3Cl2 + 2Fe 2FeCl3
2FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在常见的非金属及其化合物中:
(1)晶体硅的导电性介于导体和绝缘体之间,是良好的 材料;硅酸钠水溶液俗称为 ,是制备硅胶和木材防火剂的原料;陶瓷、 、水泥等硅酸盐产品是使用量最大的无机非金属材料。
(2)氯元素是重要的“成盐元素”,将氯气通入NaOH溶液中可以得到漂白液,反应的离子方程式是 ;漂白液有效成分的化学式为 。
(3)水是常见的非金属元素化合物,请按要求写出下列水参加的反应的化学方程式。
①水只作氧化剂:
②NO2气体通入水中:
③水既作氧化剂又作还原剂:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2013年底,上海青浦发生一家三口误食亚硝酸盐造成两男孩身亡的惨剧。常见的亚硝酸盐主要是亚硝酸钠(NaNO2),它是一种白色不透明晶体,虽然形状很像食盐,而且有咸味,但有毒。亚硝酸钠和氯化钠的部分资料如下表:
| | 亚硝酸钠(NaNO2) | 氯化钠(NaCl) |
| 水溶性 | 易溶,溶液呈弱碱性 | 易溶,溶液呈中性 |
| 熔点 | 271℃ | 801℃ |
| 沸点 | 320℃会分解 | 1413℃ |
| 跟稀盐酸作用 | 有红棕色的NO2气体放出 | 无反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g) +N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
2CO2(g) +N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。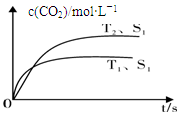
据此判断:
(1)该反应的ΔH 0(选填“>”、“<”)。
(2)若在一定温度下,将1.0 mol NO、0.5 mol CO充入0.5 L固定容积的容器中,达到平衡时NO、CO、CO2、N2物质的量分别为:0.8 mol、0.3 mol、0.2 mol、0.1 mol,该反应的化学平衡常数为K= ;若保持温度不变,再向容器中充入CO、N2各0.3 mol,平衡将 移动(选填“向左”、“向右”或“不”)。
Ⅱ.以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。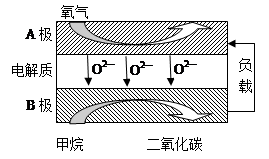
回答下列问题:
(1)B极为电池 极,电极反应式为 。
(2)若用该燃料电池做电源,用石墨做电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标况下)。
Ⅲ.FeS饱和溶液中存在:FeS(s) Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常温下Ksp=1.0×10-16。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为 。
Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常温下Ksp=1.0×10-16。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
物质在水溶液中有不同的行为。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有___________,不变的有____________。
a.溶液中离子浓度 b.氨水的电离程度
c.水的离子积常数 d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填“相同”或“不相同”),其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
(1)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为 。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g) ΔH < 0
2N2(g)+3H2O(g) ΔH < 0
为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
(3)利用ClO2氧化氮氧化物。其转化流程如下:
NO NO2
NO2 N2
N2
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O = NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
(4)利用CO催化还原氮氧化物也可以达到消除污染的目的。
已知质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图是反应2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H 0 (填“>”、“<”或“无法确定”);催化剂表面积S1 S2 (填“>”、“<”或“无法确定”)。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H 0 (填“>”、“<”或“无法确定”);催化剂表面积S1 S2 (填“>”、“<”或“无法确定”)。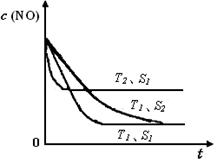
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.某实验A小组设计生产亚氯酸钠(NaClO2)的主要流程如图,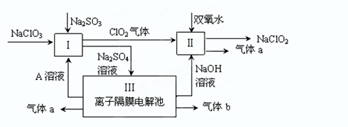
已知NaClO2是一种强氧化性漂白剂,广泛用于纺织、印染工业。它在碱性环境中稳定存在。
(1)双氧水的电子式为 ,装置Ⅰ中发生反应的还原剂是 (填化学式)。
(2)A的化学式是 ,装置Ⅲ电解池中A在 极区产生,若装置Ⅲ中生成气体a为 11.2 L(标准状况),则理论上通过电解池的电量为 (已知法拉第常数F="9.65×l" 04C· mol-1)。
(3)装置Ⅱ中反应的离子方程式是 。
Ⅱ.某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸: Sn+ 2HCl=SnCl2+H2↑,过滤,洗涤。将滤液和洗涤液合并再加过量的FeCl3溶液。最后可用一定浓度的K2Cr2O7酸性溶液滴定生成的Fe2+,此时还原产物为Cr3+。现有锡合金试样1.23g,经上述反应、操作后,共用去0.200mol/L的K2Cr2O7的酸性溶液15.00mL。
(4) 列式计算样品中锡的质量分数。
(5)用上述样品模拟工业上电解精炼锡,如图: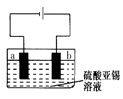
b极发生电极反应式 ,当得到11.90g纯锡时,电解质溶液质量减轻0.54g,则锡合金质量减少_______ g(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com