
 据图回答以下问题:
据图回答以下问题:| 0.3mol×2 |
| 2 |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
| 实验装置 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
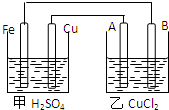
 将反应Cu+2FeCl3=CuCl2+2FeCl2设计成原电池,在图框中画出原电池的装置图,标出正、负极,并写出电极反应式.
将反应Cu+2FeCl3=CuCl2+2FeCl2设计成原电池,在图框中画出原电池的装置图,标出正、负极,并写出电极反应式.查看答案和解析>>
科目:高中化学 来源: 题型:
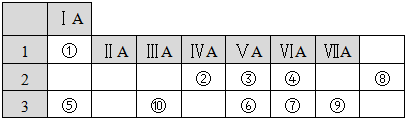
| 实验 混合溶液 |
A | B | C | D | E | F |
| 4mol?L-1H2SO4溶液/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
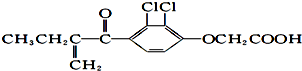
| A、利尿酸的化学式为:C13H14O4Cl2 |
| B、1mol 利尿酸最多可与4 mol H2发生反应 |
| C、利尿酸可使溴的四氯化碳溶液褪色 |
| D、利尿酸在一定条件下能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、C(石墨)=C(金刚石),在该反应进程中其能量变化如下图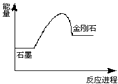 |
| B、Ba(OH)2?8H2O与NH4Cl反应 |
| C、灼热的碳与CO2反应 |
| D、甲烷在氧气中燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com