
(一)向一容积不变的密闭容器中充入一定量A和B,发生如下反应: x A(g) +2B(s) y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
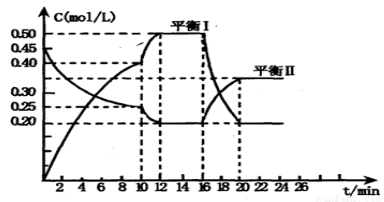
(1)0~l0min容器内压强____ (填“变大”,“不变”或“变小”)
(2)推测第l0min引起曲线变化的反应条件可能是 ;第16min引起曲线变化的反应条件可能是____ ;
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
(3)若平衡I的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1 __________ K2(填“>”“=”或“<”)
(二) 尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。

A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为________________________。
(2)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)  NH2COONH4(s) 关于上述反应的平衡状态下列说法正确的是________________
NH2COONH4(s) 关于上述反应的平衡状态下列说法正确的是________________
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:2016届福建省大田市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列关于铁的叙述正确的是
①铁能被磁铁吸引,但纯铁比含杂质的铁易被腐蚀
②在人体的血红蛋白中含有铁元素
③铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧
④铁与强氧化剂硝酸反应的产物只有一种是Fe(NO3)3
⑤不能通过化合反应制得FeCl2和Fe(OH)3
A.①③ B.②③ C.②⑤ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市高三上学期10月月考化学试卷(解析版) 题型:推断题
A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为 。
(2)由A、B、W三种元素组成的18电子微粒的电子式为 。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式 ,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是 。(标准状况下)。
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽师大附属中学高二上期中测试化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列说法正确的是
A.14g聚乙烯中所含原子数为3NA
B.48g甲硫醇(CH4S)中含有C—H键数目为4NA
C.标准状况下,11.2L氯仿所含分子数为0.5NA
D.0.1mol苯乙烯中含有双键的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上期中测试化学试卷(解析版) 题型:填空题
(12分)已知实验室制取C12的反应为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成C12;
MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成C12;
(1)写出PbO2与浓盐酸反应的化学方程式 ,其中表现还原性的HCl与表现酸性的HCl的物质的量之比为 。
(2)PbO2不稳定,随温度升高按下列顺序逐步分【解析】
PbO2→Pb2O3→Pb3O4→PbO。若加热分解后所得到的固体全部为Pb3O4,现将a molPbO2加热分解,则加热过程中放出O2__ ___L(标准状况下);
(3)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下:PbSO4+2CH3COONH4= (CH3COO)2Pb+(NH4)2SO4。
①PbSO4与CH3COONH4能进行反应的原因是符合了复分解反应条件之一的生成了 ,现将Na2S溶液与醋酸铅溶液混合有沉淀生成,则其反应的离子方程式应为 。
②已知+2价Sn的化合物具有强还原性。等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中,溶液中存在的主要金属阳离子是 (填序号)。
A.Pb2+ B.Pb4+ C.Sn2+ D.Sn4+
查看答案和解析>>
科目:高中化学 来源:2016届福建省福州市高三上学期期中测试化学试卷(解析版) 题型:填空题
(12分)HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+.AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为 Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是____________(填序号)。
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是____________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:____________________。
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是___________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
FeSO4+ K2O2→ K2FeO4+ K2O+ K2SO4+ O2↑
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是______________________。
查看答案和解析>>
科目:高中化学 来源:2016届河南省林州市高三上学期9月质检化学试卷(解析版) 题型:选择题
原子序数依次增大的四种短周期元素X、Y、Z、W,X与Z同主族且X最外层电子比次外层电子多2个,Y元素的周期序数等于族序数,W元素的最高正价与最低负价代数和为4,下列说法错误的是
A.最高价氧化物对应水化物的酸性:W>X>Z>Y
B.氢化物的稳定性:X>Z
C.Y单质可用于钢轨的焊接
D.原子半径大小顺序:X<Y<Z<W
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期10月联考化学试卷(解析版) 题型:选择题
某同学设计下列方法对A盐的水溶液进行鉴定

由此得出的结论中,不正确的是
A.A一定是FeBr3 B.B为AgBr
C.滤液C中有Fe3+ D.D溶液中存在Fe(SCN)3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法或表示方法正确的是
A.反应物总能量低于生成物总能量时,该反应不能发生
B.强酸跟强碱反应放出的热量称为中和热
C.由石墨比金刚石稳定可知,C(石墨,固)=C(金刚石,固)△H>O
D.在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式表示为:2H2(g)十02(g)=2H2O(l);△H=-285.8KJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com