
【题目】(1)已知75mL2mol∕L NaOH溶液的质量为80g,计算溶液中NaOH的质量分数。___
(2)乙酸是实验室常用的一种化学试剂,某乙酸试剂瓶上标签的部分内容如图所示。利用标签提供的信息,回答下列问题:
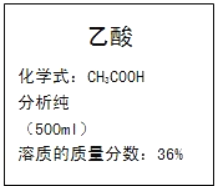
①乙酸的摩尔质量为___。
②若该乙酸溶液的密度为1.02g/cm3,求此乙酸溶液的物质的量浓度。___
③某实验中要用2mol·L-1的乙酸溶液306ml,需要取用上述乙酸溶液多少毫升?___
【答案】7.5% 60g/mol 6.12mol/L 100mL
【解析】
(1)计算溶液中NaOH的质量分数,需要先确定溶质的质量和溶液的质量,然后利用公式w%=![]() 进行计算。
进行计算。
(2)①乙酸的摩尔质量与乙酸的相对分子质量数值相等,单位为mol/L。
②求此乙酸溶液的物质的量浓度,利用公式c=![]() 进行计算。
进行计算。
③利用稀释前后溶质的物质的量相等,计算需要取用上述乙酸溶液的体积。
(1)m(NaOH)=2mol/L×0.075L×40g/mol=6g,
w%=![]() =
=![]() ,
,
答案:7.5%。
(2)①乙酸的摩尔质量为(12×2+1×4+16×2)g/mol=60g/mol;
答案:60g/mol。
②c(CH3COOH)=![]() mol/L;
mol/L;
答案:6.12mol/L。
③6.12mol/L×V=2mol·L-1×306mL,
V=100mL;
答案:100mL。


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】将1.0 mol/L盐酸逐滴滴入到100 mL含有NaOH、NaAlO2和Na2CO3的混合溶液中,反应过程如图所示。下列有关说法不正确的是
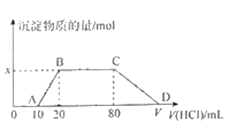
A. 混合液中NaOH的物质的量浓度为0.1 mol/L
B. x=0.01
C. BC段的反应过程离子方程式为:CO![]() +H+ ====HCO
+H+ ====HCO
D. V=110
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+. Mg2+. SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
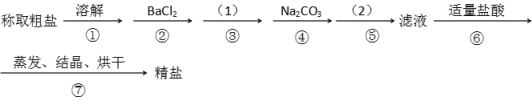
(1)第④步中,写出相应的离子方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)_______________ ;____________。
(2)实验方案的(1)中应使用除杂试剂的化学式__________,发生的离子方程式是__________,在实验方案的(2)中的操作名称是_______。
(3)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。___________________________________________;
(4)判断BaCl2已过量的方法是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e—结构。写出其电子式_____________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学方程式为______________。
(2)已知:2CO2(g) + 3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l) △H=-4a kJ/mol
CO2(g) +2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=-b kJ/mol
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:____________。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(CO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
②该反应的△H______0(填“>”或“<”)。
③甲、丙容器达到平衡时,CO的转化率为α(甲)________α(乙)(填“>”,“< ”,“=”)
(4)常温下,在(NH4)2C2O4溶液中,反应NH4++C2O42—+H2O![]() NH3·H2O+HC2O4—的平衡常数K=___。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)
NH3·H2O+HC2O4—的平衡常数K=___。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学镀铜废液中含有一定量的CuSO4,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过。已知:①Cu2++ HCHO + 3OH-=Cu + HCOO-+ 2H2O;②还原性:HCHO > M(—种金属)> Cu。
下列说法正确的是
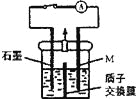
A. 反应之前,应将含OH-的HCHO溶液加入到装置的左侧
B. 右侧发生的电极反应式:HCHO-2e-+H2O=HCOO-+3H+
C. 若将质子交换膜换成阴离子交换膜,放电过程中,大量的OH-将向左侧迁移
D. 放电一段时间后打开开关,移去质子交换膜,装置中可能会有红色固体、蓝色絮状物出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物a和苯通过反应合成b 的过程如图(无机小分子产物略去)。下列说法正确的是
![]()
A. 该反应是加成反应
B. 若R为CH3时,b中所有原子可能共面
C. 若R为C4H9时,取代b苯环上的氢的一氯代物的可能的结构共有4种
D. 若R为C4H5O时,lmolb最多可以与5molH2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
B. 由实验数据可知该反应较适宜的温度为T1
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用某化合物X(两种短周期元素组成的纯净物)进行了如下实验:

实验步骤②中还观测到生成黑色固体和无色无味气体,生成的溶液可作为建筑行业的一种黏合剂。
请回答:
(1)X的化学式是____,步骤①的离子方程式是___。
(2)步骤②的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn在现代工业中对于电池制造上有不可磨灭的地位,明朝末年宋应星所著的《天工开物》一书中就有世界上最早的关于炼锌技术的记载。回答下列问题:
(1)Zn基态原子的电子排布式为___________,4s能级上的成对电子数为___________。
(2)葡萄糖酸锌{[CH2OH( CHOH)4COO]2Zn}是目前市场上流行的补锌剂。葡萄糖酸锌中碳原子杂化形式有___________,C、H两元素的第一电离能的大小关系为___________________。
(3)ZnCl2与NH3形成的配合物[Zn(NH3)4]Cl2中,存在___________(填字母)。
A离子键 B.σ键 C.π键
(4)锌与某非金属元素X形成的化合物晶胞如图所示,其中Zn和X通过共价键结合,该化合物中Zn与X的原子个数之比为___________。
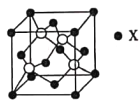
(5)在图示晶胞中若只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的___________堆积;设阿伏加德罗常数的数值为NA,该晶胞中Zn的半径为r1nm,X的半径为r2nm,X的相对原子质量为M,则该晶体的密度为___________g·cm-3(用含r1、r2、M、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com