
【题目】亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生。它的部分性质见右图,下列说法错误的是

A.可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2)
B.N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键
C.NaNO2与N2H4生成NaN3的反应方程式为:NaNO2+N2H4 = NaN3 + 2H2O
D.上图所涉及到的化学反应都是氧化还原反应
科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279. 7 mL。
⑤准确称量试管和残留物的质量为15. 55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________。
(2)以下是测量收集的气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同;
②使试管和广口瓶内气体都冷却至室温;
③读取量筒内液体的体积。
这三步操作的正确顺序是_________________(请填写步骤代号)。
进行③的实验操作时,若仰视读数,则读取氧气的体积_______(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是_____mol;实验测得氧气的气体摩尔体积是______(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2O4(无色)![]() 2NO2(红棕色) 现有如右图所示的三个烧瓶,分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(I)中加入无水CaO,在(III)中加入NH4Cl晶体,(II)中不加其他任何物质,发现(I)中红棕色变深,(III)中红棕色变浅,下列叙述正确的是 ( )
2NO2(红棕色) 现有如右图所示的三个烧瓶,分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(I)中加入无水CaO,在(III)中加入NH4Cl晶体,(II)中不加其他任何物质,发现(I)中红棕色变深,(III)中红棕色变浅,下列叙述正确的是 ( )

A. CaO溶于水时吸收热量 B. 该反应的ΔH>0
C. NH4Cl溶于水时放出热量 D. 烧瓶(III)中气体的压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。试完成以下问题:

(1)电源A极的名称是________。
(2)甲装置中电解反应的总化学方程式是____________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是________。
(4)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”),电镀液的主要成分是________(填化学式) 。
(5)装置丁的现象是________,说明________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度为2 mol/L的HCl溶液VL,欲使其浓度变为4 mol/L,下列方法可行的是( )
A. 通入标准状况下的HCl气体44.8 L
B. 将溶液加热蒸发浓缩至0.5V L
C. 加入10 mol/L盐酸0.6V L,再将溶液稀释至2V L
D. 蒸发掉0.5 L水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性ZnO在橡胶、塑料、涂料工业有重要应用,工业上用含锌物料(含FeO、CuO等杂质)制取活性ZnO的流程如图所示:

(1)上述流程中,浸出时用的是60% H2SO4(密度是1.5 g/cm3),则该H2SO4的物质的量浓度为______________ (保留两位小数) 。
(2)上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04 mol·L-1,控制滤液的pH,加入H2O2后产生大量红褐色沉淀。
①粗略测定溶液pH的实验操作是___________________________________________。
②已知:常温下Fe(OH)3的Ksp=4.0×10-38。滤液的pH至少为________时,溶液中Fe3+开始沉淀。
(3)A溶液中主要含有的溶质是______________,验证溶质所含阳离子的方法是_____________。
(4)制备ZnO所焙烧的物质是含结晶水的碱式碳酸锌。取碱式碳酸锌6.82g,溶于HCl生成CO2 448 mL(标准状况下),溶解过程消耗HCl 0.12mol,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱式碳酸锌的化学式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的![]() 及泥沙,可将粗盐溶于水,然后进行下列五项操作。正确的操作顺序是( )
及泥沙,可将粗盐溶于水,然后进行下列五项操作。正确的操作顺序是( )
①过滤 ②加过量![]() 溶液 ③加过量盐酸
溶液 ③加过量盐酸
④加热煮沸 ⑤加过量的![]() 溶液 ⑥过量
溶液 ⑥过量![]() 溶液。
溶液。
A.②⑤⑥①③④B.⑤②⑥③①④C.⑥②⑤③④①D.⑥②①⑤③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为“氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,等钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是
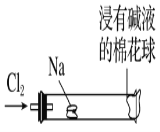
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气
C.钠着火产生黄色火焰,自然界中存在游离态钠
D.若在棉花球外沿滴一滴石蕊溶液,据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是

A.反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.10s后,该反应停止进行
C.反应开始到10s,用Z表示的反应速率为0.158mol·L-1·s-1
D.0~10 s的时间内的平均反应速率:v(X)=v(Y)=0.0395mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com