
【题目】下列关于硫及含硫化合物的叙述正确的是( )
A.SO2的漂白原理与次氯酸相同B.浓硫酸可以干燥H2、NH3、CO2等气体
C.浓硫酸具有吸水性,能使pH试纸变黑D.硫与铜在加热条件下反应生成Cu2S
科目:高中化学 来源: 题型:
【题目】下列不属于可逆反应的是( )
A.Pb+PbO2+4H++2SO42﹣ ![]() 2PbSO4+2H2O
2PbSO4+2H2O
B.2SO2+O2 ![]() 2SO3
2SO3
C.Cl2+H2O?HCl+HClO
D.2NO2?N2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去). 
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出E中含有的化学键类型;已知1molA与水反应放出283.5kJ的热量,试写出A与水反应的热化学反应方程式;
(2)若A 为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则单质A与H2O反应的离子方程式 .
(3)若A 为淡黄色粉末,回答下列问题: ①1molA与足量的H2O充分反应时,转移电子总数为
②若X为非金属单质,通常为黑色粉末,写出D的结构式
(4)若A为氧化物,X是Fe,溶液D加入KSCN溶液变红. ①A与H2O反应的离子方程式
②请用离子方程式表示D盐的净水原理 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是
A.乙醇在空气中燃烧
B.光照条件下,甲烷与氯气发生反应
C.乙烯使溴的四氯化碳溶液褪色
D.在镍做催化剂的条件下,苯与氢气发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】613C-NMR(核磁共振)可以用于含碳化合物的结构分析,613C表示的碳原子( )
A.核外有13个电子B.核内有6个质子,核外有7个电子
C.质量数为13,核内有7个质子D.质量数为13,核内有7个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,甲、乙均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
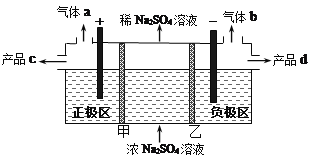
A. 甲为阳离子交换膜,通电后中间隔室的Na+离子向正极迁移
B. 通电后,同温同压下得到的气体a与气体b的体积比约为2:1
C. 通电后,得到的产品c是NaOH,产品d是H2SO4
D. 负极区发生的电极反应为2H2O +2e-=2OH-+H2↑,负极区溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一酸两浸,两碱联合”法是实现粉煤灰(含SiO2、Al2O3、Fe2O3、CaO、MgO等)综合利用的新工艺。工业流程如下:
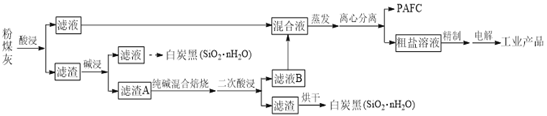
回答下列问题:
(1)聚合氯化铝铁(PAFC)化学式为[Al2(OH)nCl6-n]m·[Fe2(OH)xCl6-x]y,是一种新型高效的净水剂,PAFC中铁元素的化合价为___________。
(2)“一酸两浸”中的酸是________________(填化学式)。
(3)实际工业中“酸浸”、“碱浸”均不能充分反应,滤渣A中主要含有SiO2、Al2O3。“纯碱混合焙烧”中,它们分别发生反应的化学方程式为__________、________。
(4)“滤液B”的主要溶质有_________(填化学式)。滤液混合后“蒸发”的作用是__________________。
(5)“电解”时阳极的电极反应式为_______________。
(6)PAFC、无水AlCl3、FeCl3·6H2O用量均为25 mg·![]() 时,处理不同pH污水的浊度去除率如图所示,PAFC的优点是________。
时,处理不同pH污水的浊度去除率如图所示,PAFC的优点是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取等物质的量的MgO和Fe2O3的混合物进行铝热反应,反应的化学方程式为________,引发铝热反应的实验操作是____。
(2)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。写出Be与NaOH溶液反应生成Na2 [Be(OH) 4]的离子方程式__________________。
(3)5.4g某元素R的单质与足量的盐酸反应,生成RCl3和6.72L氢气,R的质子数比中子数少1个,则R的原子符号为______________,R的氧化物溶于强碱的离子方程式______________。
(4)实验室不能用带玻璃塞试剂瓶装NaOH溶液,用化学方程式和简要文字说明_____________。
(5)作为麻醉剂,氙气在医疗上很受重视,它的原子序数是____。取1mol氙气和3.5mol氟气于一密闭容器内充分反应,后来余下了1.5mol的氟气同时有白色固体生成 ,此白色固体的化学式为_________。
(6)若要使1mol CH4完全和Cl2发生取代反应,并生成相同物质的量的四种取代产物,则生成HCl的物质的量为________。
A.5 mol B.4mol
C.2.5mol D.1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com