
| pH | 6.5��8.5 |
| Ca2+��Mg2+ | <0.004 5 mol��L-1 |
| ϸ������ | <100��/mL |
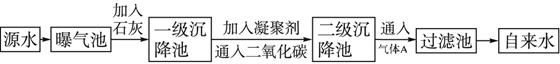
 Fe��OH��2+2H+,Fe��OH��2��Ѹ�ٱ�������Fe��OH��3:4Fe��OH��2+O2+2H2O=4Fe��OH��3,��������Fe��OH��3������
Fe��OH��2+2H+,Fe��OH��2��Ѹ�ٱ�������Fe��OH��3:4Fe��OH��2+O2+2H2O=4Fe��OH��3,��������Fe��OH��3������


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
| ʵ����� ʵ����� | ������Һ /mL | ��ȩ���� /�� | ˮҺ�¶�/�� | ��Ӧ���Һ��PH | ��������ʱ��/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
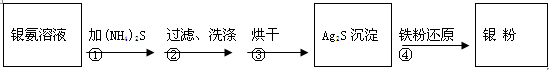
 2 Ag+ FeCl2+H2S����
2 Ag+ FeCl2+H2S����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
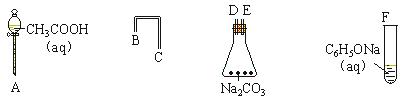
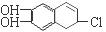 �ֱ���Ũ��ˮ��NaOH��Һ��ȫ��Ӧ������Br2��NaOH�����ʵ����ֱ��� mol�� mol��
�ֱ���Ũ��ˮ��NaOH��Һ��ȫ��Ӧ������Br2��NaOH�����ʵ����ֱ��� mol�� mol���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ʵ�鷽�� | ʵ������ |
| �ٽ���ˮ�μӵ��廯����Һ�У����������CCl4��Һ�������� | A.����ˮ���ϣ��۳�С�������ƶ�����֮��ʧ |
| �ڽ�һС������Ʒ�����ˮ�� | B.�ֲ㣬�ϲ���ɫ���²���ɫ |
| �۽���ˮ�μӵ�NaI��Һ�У����ټ�������CCl4���������� | C.����ˮ���ϣ��۳�С�������ƶ������������ı�ը�����ܿ���ʧ |
| �ܽ�һС������ط�����ˮ�� | D.�ֲ㣬�ϲ���ɫ���²��ɫ |
| ʵ�鷽�� | ʵ������ | ��ѧ����ʽ |
| �� | | |
| �� | | |
| �� | | |
| �� | | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
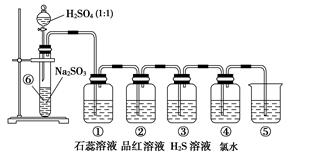
| װ�� | ʵ������ | ����SO2������ |
| �� | | |
| �� | | |
| �� | | |
| �� | | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
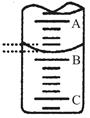
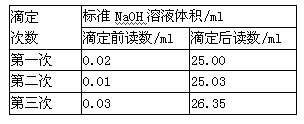
| A��c��Na+����c��CH3COO���� | B��c��Na+����c��CH3COO���� |
| C��c��Na+��=c��CH3COO���� | D������ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Ũ����ϡ�ͺ�û����ȴֱ��ת�Ƶ�����ƿ�� | B������ʱ���ӿ̶��� |
| C��ת�ƹ�����û��ϴ��С�ձ� | D������ƿϴ����û�и��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Һʱ����Һ©���²�Һ����¿ڷų����ϲ�Һ����Ͽڵ��� |
| B������ʱ��Ӧʹ�¶ȼ�ˮ����������ƿ֧�ܿ� |
| C�������ᾧʱӦ����Һ���� |
| D������ʱ����������ڳ���ֽ�ϣ�������ƽ���̣����������ƽ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����1mol�Ĵ�����Һ��1.01mol������������Һ���к���ʵ�����к��ȵ���ֵΪ57.3KJ/mol |
| B��ͨ��ʵ���֪�ڳ��³�ѹ��,12g����C��32g����O2�����е�������һ������44g����CO2�����е������� |
| C��������,�ù㷺pH��ֽ���ij��Һ��pHΪ2.3 |
| D����25mL�ζ������к͵ζ�ʱ����ȥijŨ�ȵļ���Һ21.7mL |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com