
【题目】对于可逆反应:2A(g)+B(g)![]() 2C(g) ΔH <0,下列各图中正确的是( )
2C(g) ΔH <0,下列各图中正确的是( )
A.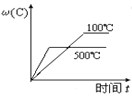 B.
B.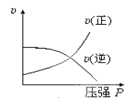
C.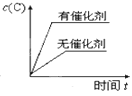 D.
D.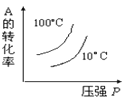
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,发生反应:3A(g)+B(g)![]() 2C(g)△H=-QkJ/mol在3个密闭容器中,按下列方式投入反应物:
2C(g)△H=-QkJ/mol在3个密闭容器中,按下列方式投入反应物:
Ⅰ.3molA,1molB;Ⅱ.6molA,2molB;Ⅲ.4molC
则在保持恒温恒容反应达到平衡时,下列选项正确的是( )
A.容器Ⅰ与容器Ⅱ中,C的浓度2cⅠ<cⅡ,平衡常数KⅠ=KⅡ,转化率aⅠ>aⅡ
B.容器Ⅰ与容器Ⅲ中,B的体积分数vⅠ%>vⅢ%,反应的能量变化2QⅠ=QⅢ,平衡常数KⅠ2=![]()
C.容器Ⅱ与容器Ⅲ为等效平衡,B的体积分数VⅡ%=VⅢ%,转化率aⅢ+aⅡ=1,反应的能量变化QⅡ+QⅢ=Q
D.容器Ⅰ容器Ⅱ容器Ⅲ中,平衡常数关系为:KⅠ2=KⅡ=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用语言来描述,现有下列化学用语:①Cl-的结构示意图:![]() ;②羟基的电子式:
;②羟基的电子式:![]() ;③HClO的结构式:H—Cl—O;④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-;⑤CO2的比例模型:
;③HClO的结构式:H—Cl—O;④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-;⑤CO2的比例模型:![]() ;⑥原子核内有10个中子的氧原子:188O。其中说法正确的是( )
;⑥原子核内有10个中子的氧原子:188O。其中说法正确的是( )
A.①④⑤⑥B.①②⑥C.①②③⑥D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示操作能实现实验目的的是( )
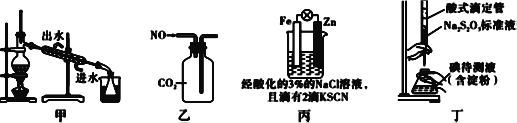
A. 用图甲装置分离碘和四氯化碳,在锥形瓶中收集到碘单质
B. 用图乙装置收集NO气体
C. 用图丙装置验证牺牲阳极的阴极保护法
D. 用图丁装置测定待测液中I2的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
④H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ 热量
C.氢气的燃烧热为241.8kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.工业上用熔融的金属钠制取金属钾:KCl(l)+Na(l)![]() NaCl(l)+K(g)
NaCl(l)+K(g)
B.对于反应2HI(g)![]() H2(g)+I2 (g),达到平衡后缩小容器体积可使体系颜色变深
H2(g)+I2 (g),达到平衡后缩小容器体积可使体系颜色变深
C.氨水中加入NaOH固体有利于氨气的溢出
D.实验室用排饱和食盐水的方法来收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+ CO2(g)=2CO(g)+2H2(g) △H=+247kJ/mol;
①有利于提高CH4平衡转化率的条件是____
A. 高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应CH4(g)= C(s)+2H2(g) | 消碳反应CO2(g)+ C(s)= 2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/(kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________
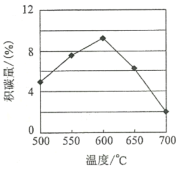
A.K积、K消均增加
B.v积减小,v消增加
C.K积减小,K消增加
D.v消增加的倍数比v积增加的倍数‘
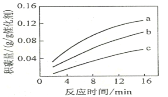
②在一定温度下,测得某催化剂上沉积碳的生成速率方v=k·p(CH4)·![]() (k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一,现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述正确的是
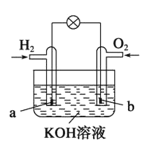
A.总反应方程式为2H2+O2![]() 2H2O
2H2O
B.a极反应是H2-2e-=2H+
C.使用过程中电解质溶液的pH逐渐减小
D.b电极是正极,该电极上发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com