
����Ŀ�������ϵĵ�Ԫ�ضԶ�ֲ������Ҫ���ã����а��ĺϳ���Ӧ���ǵ�ǰ���о��ȵ㡣
��1����ͬ�¶��¹�ҵ�ϳɰ�N2(g)+3H2(g)![]() 2NH3(g)��Ӧ�IJ���Kֵ���±���
2NH3(g)��Ӧ�IJ���Kֵ���±���
�¶�/�� | 25 | 400 | 450 |
K | 5��108 | 0.507 | 0.152 |
�ٹ�ҵ�ϳɰ���Ӧƽ�ⳣ������ʽΪK=___��
������ƽ�ⳣ�����ͣ��÷�ӦΪ���ȷ�Ӧ������___��
�۴�ƽ���ӽǿ��ǣ���ҵ�̵�Ӧ��ѡ������������ʵ�ʹ�ҵ����ȴѡ��500�����ҵĸ��£�������ԭ��___��
��2����ѧ�����õ�ⷨ�ڳ��³�ѹ��ʵ�ֺϳɰ�������ʱ����������ʾ��ͼ��ͼ�����е��ҺΪ�ܽ�����������﮺��Ҵ��Ķ����л��ܼ���

������������NH3�ĵ缫����ʽΪ___��
������˵������ȷ����___������ĸ��ţ���
a.��������﮵���������ǿ������
b.��װ���ý�(Au)������Ŀ���ǽ���N2�ļ���
c.ѡ������Ĥ������N2��NH3ͨ������ֹH2O����װ��
���𰸡�![]() ���¶����ߣ�ƽ�ⳣ����С��ƽ�����淴Ӧ�����ƶ�����Ӧ����Ϊ���ȷ�Ӧ �����ʽǶȿ��ǣ����¸��ã��Ӵ����Ƕȿ��ǣ�500�����Ҵ������Ը��� N2+6e-+6C2H5OH=2NH3+6C2H5O- b
���¶����ߣ�ƽ�ⳣ����С��ƽ�����淴Ӧ�����ƶ�����Ӧ����Ϊ���ȷ�Ӧ �����ʽǶȿ��ǣ����¸��ã��Ӵ����Ƕȿ��ǣ�500�����Ҵ������Ը��� N2+6e-+6C2H5OH=2NH3+6C2H5O- b
��������
1���ٻ�ѧƽ�ⳣ����ָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ������Ũ����֮���뷴Ӧ��Ũ�ȵ���֮���ı�ֵ��
�������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����ɱ������ݿ�֪�������¶ȣ��ϳɰ���Ӧƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ���
�ۺϳɰ���Ӧ�У���Ӧ�¶�Խ�ߣ���Ӧ����Խ�죬���Ǹ÷�ӦΪ���ȷ�Ӧ���¶ȸ�ת���ʻή�ͣ�������500�����Ҵ���������ߣ����ԴӴ������Ե��ۺ����ؿ���ѡ��500�����Һ��ʣ�
��2����������������ʾ��ͼ��֪��������N2ת��ΪNH3��C2H5OHת��ΪC2H5O-���ӣ�˵��N2��C2H5OH�����£��������õ����ӷ�����ԭ��Ӧ����NH3��
��a. ���ҺΪ�ܽ�����������﮺��Ҵ��Ķ����л��ܼ�����������������ӻ�������ṩ���ӣ�
b.�����ܽ��ͷ�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ����ܽ��ͷ�Ӧ��ļ��ܣ�
c.��ͼ��֪��ˮ��ѡ������Ĥ���Ϸ���
��1������ѧƽ�ⳣ����ָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ������Ũ����֮���뷴Ӧ��Ũ�ȵ���֮���ı�ֵ����ҵ�ϳɰ���Ӧƽ�ⳣ������ʽΪK=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
�������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����ɱ������ݿ�֪�������¶ȣ��ϳɰ���Ӧƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ�����ϳɰ���ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����¶����ߣ�ƽ�ⳣ����С��ƽ�����淴Ӧ�����ƶ�����Ӧ����Ϊ���ȷ�Ӧ��
���ϳɰ���Ӧ�У���Ӧ�¶�Խ�ߣ���Ӧ����Խ�죬���Ǹ÷�ӦΪ���ȷ�Ӧ���¶ȸ�ת���ʻή�ͣ�������500�����Ҵ���������ߣ����ԴӴ������Ե��ۺ����ؿ���ѡ��500�����Һ��ʣ��ʴ�Ϊ�������ʽǶȿ��ǣ����¸��ã��Ӵ����Ƕȿ��ǣ�500�����Ҵ������Ը��ߣ�
��2����������������ʾ��ͼ��֪��������N2ת��ΪNH3��C2H5OHת��ΪC2H5O-���ӣ�˵��N2��C2H5OH�����£��������õ����ӷ�����ԭ��Ӧ����NH3���缫��ӦʽΪN2+6e-+6C2H5OH=2NH3+6C2H5O-���ʴ�Ϊ��N2+6e-+6C2H5OH=2NH3+6C2H5O-��
��a. ���ҺΪ�ܽ�����������﮺��Ҵ��Ķ����л��ܼ�����������������ӻ�������ṩ���ӣ���ǿ���Һ�ĵ����ԣ���a��ȷ��
b.�����ܽ��ͷ�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ����ܽ��ͷ�Ӧ��ļ��ܣ���װ���ý�(Au)������Ŀ���ǽ���N2�Ļ�ܣ� ��b����
c.��ͼ��֪��ˮ��ѡ������Ĥ���Ϸ���˵��ѡ������Ĥ������N2��NH3ͨ������ֹH2O����װ�ã���c��ȷ��
�ʴ�Ϊ��b��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��NaCl��Na2CO3��10H2O��NaHCO3�Ļ���ijͬѧ�����ͼ��ʾ��ʵ��װ�ã�ͨ��������Ӧ������CO2��H2O����������ȷ���û�����и���ֵ�����������

(1)ʵ�鲽�裺
�ٰ�ͼ(�г�����δ����)��װ��ʵ��װ�ú����Ƚ��еIJ�����__________��
�ڳ�ȡ��Ʒ�����������Ӳ�ʲ������У�����װŨ�����ϴ��ƿC��������װ��ʯ�ҵ�U�ι�D��������
�۴���K1��K2���ر�K3������������������ӣ���Ŀ����________��
�ܹرջ���K1��K2����K3����ȼ�ƾ��Ƽ��������ٲ������塣װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ________��________��
�ݴ���K1������������������ӣ�Ȼ�����װ�ã��ٴγ���ϴ��ƿC��������U�ι�D��������
(2)���ڸ�ʵ�鷽������ش��������⡣
�������ȷ�Ӧ����������Բⶨ�����Ӱ����_______________��
��E���������ʢ�ŵ�ҩƷ�Ǽ�ʯ�ң���������_____________�����ʵ����û�и�װ�ã���ᵼ�²������NaHCO3������_____________(����ƫ������ƫС��������Ӱ����)��
������Ʒ����Ϊw g����Ӧ��C��Dװ�����ӵ������ֱ�Ϊm1g��m2g����������Na2CO3��10H2O����������Ϊ________(�ú�w��m1��m2�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƫ������[(CH3)2N��NH2]�� N2O4 �dz��õĻ���ƽ������������ʱ�����ֺ���ɫ���壬�����Ļ�ѧ��Ӧ���£�
�� (CH3)2N��NH2(1)+2N2O4(1) = 2CO2(g)+3N2(g)+4H2O(g) ��H1��0
��N2O4(1) ![]() 2NO2(g) ��H2��0
2NO2(g) ��H2��0
����˵������ȷ���� ( )
A.��Ӧ���У�N2O4 Ϊ������
B.��Ӧ���У�����1mo1CO2 ʱ��ת��16mo1e-
C.�ɷ�Ӧ���ƶϣ���ѹ�������ǻ��Һ̬ N2O4������
D.�¶����ߣ���Ӧ�ٵĻ�ѧ��Ӧ���ʼ�С����Ӧ�ڵĻ�ѧ��Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.00 mL 0.100 mol��L��1 CH3COONa��Һ����μ���0.100 0 mol��L��1���ᣬ��Һ��pH��������������Ĺ�ϵ����ͼ��ʾ(�����ǻӷ�)������˵����ȷ����

A. �����ʾ��Һ�У�c(CH3COOH)��c(Cl��)��c(OH��)��c(H��)
B. �����ʾ��Һ�У�c(Na��)��c(Cl��)��c(CH3COO��)��c(CH3COOH)
C. �����ʾ��Һ�У�c(CH3COOH)��c(Na��)��c(H��)��c(CH3COO��)
D. ���������п��ܳ��֣�c(H��)��c(Na��)��c(CH3COOH)��c(CH3COO��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��ŵ������ѧ������������ӵ�ؿ�������λ��ѧ�ҡ�һ������ӵ�صķ�ӦʽΪLixC6+Li1��xCoO2![]() 6C+LiCoO2��x��1���乤��ԭ����ͼ��ʾ������˵������ȷ���ǣ� ��
6C+LiCoO2��x��1���乤��ԭ����ͼ��ʾ������˵������ȷ���ǣ� ��
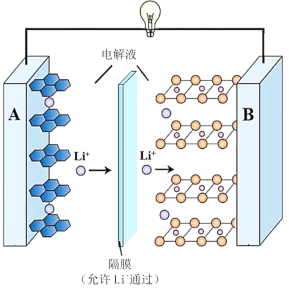
A.�ŵ�ʱA���缫ʽΪ��LixC6�Cxe-=6C+xLi+
B.�ŵ�ʱ����ת��0.3mol���ӣ�ʯī�缫������2.1g
C.���ʱ��A�������Դ������
D.�÷Ͼɵ�ؽ������ŵ紦�������������B������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ��ԭʼ����ѧ����Ϊ�����ں����������ӵ�Ũ�ȼ��ͣ�������Ԫ��δ��Ϊ����ı���Ԫ�أ��������������к�������Ҫ����ϸ�����������Գմ��IJ���֮һ��1989������������֯������ΪʳƷ��ȾԴ֮һ��ÿ��������Ӧ������4 mg���¡���ը����ʱ1 kg��������0.5 kgˮ��4 g������10 gС�մ�����ʳ�εȸ��ϣ�����ը����Ʒ�����IJ���һ��Ϊ80%��ͨ������˵����ÿ��ʳ��100 g��������������������
A.0.228 g
B.0.228 mg
C.18.8 mg
D.4 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20 mLijŨ�ȵ�AlCl3��Һ�еμ�2 mol��L��1��NaOH��Һʱ���õ�Al(OH)3����������(g)�����μ�NaOH��Һ�����(mL)��ϵ��ͼ��ʾ���Իش��������⣺
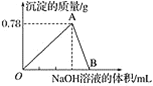
(1)ͼ��A���ʾ�ij�����__________(д��ѧʽ)�������ʵ���Ϊ____________��
(2)��Ӧ��A��ʱ����NaOH��Һ�����Ϊ______________��
(3)ͼ��B����Һ�е�������________________��
(4)AlCl3��Һ��Ũ��Ϊ______________��
(5)O�㵽B�㷴Ӧ�������ӷ���ʽ�ɱ�ʾΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ļ��������[(CH3)4NOH]��ǿ������¼װ�(CH3NH2��H2O)�ĵ��볣��ΪKb����pKb=��lgKb=3.38�������£��������Ϊ20mL��Ũ�Ⱦ�Ϊ0.1mol��L��1���ļ����������Һ�ͼװ���Һ���ֱ�μ�Ũ��Ϊ0.1mol��L��1�����ᣬ��Һ�ĵ���������������Ĺ�ϵ��ͼ��ʾ��
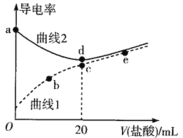
����˵����ȷ����
A.����1�����ļ����������Һ
B.�����£�CH3NH3Clˮ�ⳣ����������Ϊ10��11
C.b����Һ�д���c(H+)=c(OH��)+c(CH3NH2��H2O)
D.��b��c��e�����У�ˮ�ĵ���̶����ĵ���e
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������γɾ���ʱ��ᾧһ������ˮ���ڹ�ũҵ�����о�����Ҫ��;�����������Ӱ��������������﮵�ص�ԭ�ϵȡ�
��֪���ٲ�������������ˮ�����������Fe(SCN)63-+3C2O42-=Fe(C2O4)33-+6SCN-��
�ش��������⣺
��.��ͬѧ���ҩƷ���ָþ�����dz��ɫ����Ϊ���岻������������Ϊ���ֵ�����������Ϊ��֤�Լ��IJ��룬����ʵ����֤��ȡ�����ľ�����Ʒ����ϡ���ᣬ�μ�KSCN��Һ����Һ�����Ա仯���ɴ���Ϊ�����в�����+3�۵���������Ϊ_______�����ȷ������ȷ������������___________________________________��
��.��ͬѧΪ�ⶨ������������FeC2O4�qxH2O�еĽᾧˮ��������������װ�ã�
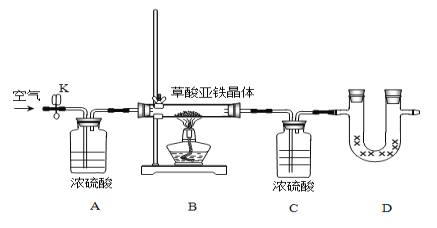
����ʵ��ǰ����Ҫ_____________________________��
�ڳ�ȡһ�������ľ��壬װ��ҩƷ����ʼʵ���������ʵ�鲽������Ϊ____________________���ظ�ʵ��ֱ��B�к��ء�
a.��ȼ�ƾ��ƣ����� b.Ϩ��ƾ��� c.�ر�K d.��K������ͨ����� e.��ȴ������ f.����
��.��ͬѧ�õζ��ķ���Ҳ���Բⶨ�������������нᾧˮ�ĺ�����ȡa�˲���������������ϡ���ᣬ�ٰ�������Һϡ�ͳ�500mL��ȡ��50mL������ƿ����������ε���δ֪Ũ�ȵ�����KMnO4��Һ����������Һ��ɫ��Ϊ�ػ�ɫ����������ð��������Һ��ɫͻ���dz��ɫ��ֹͣ�μӡ���������Һ�м����Թ�����KI��Һ�ͼ��ε�����Һ��Ȼ������c mol/L��Na2S2O3��Һ�����յ㡣����ʵ��ƽ������Na2S2O3��ҺVmL����2Na2S2O3+I2=Na2S4O6+2NaI��
��1��д������Һ�еμ�����KMnO4��Һ������Ӧ�����ӷ���ʽ_____________________
��2������������ϡ�Ͳ���������Һʱ���ձ��Ͳ������⣬������IJ���������__________
��3��x=_______________
��4����ʵ���е���KMnO4��Һ����,������xֵ___________(��ƫ��ƫС����Ӱ��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com