
【题目】2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家。一种锂离子电池的反应式为LixC6+Li1﹣xCoO2![]() 6C+LiCoO2(x<1)其工作原理如图所示。下列说法不正确的是( )
6C+LiCoO2(x<1)其工作原理如图所示。下列说法不正确的是( )
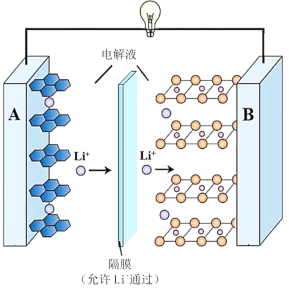
A.放电时A极电极式为:LixC6–xe-=6C+xLi+
B.放电时,若转移0.3mol电子,石墨电极将减重2.1g
C.充电时,A极接外电源的正极
D.该废旧电池进行“放电处理”有利于锂在B极回收
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol氦气中有2NA个氦原子
B.14 g氮气中含6.02×1023个氮原子
C.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6 NA个Na+
D.18 g水中所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉的水解情况,某同学设计了以下三个实验方案,并根据实验现象,得出相应的结论:
甲:淀粉液![]() 水解液
水解液![]() 溶液变蓝 实验结论:淀粉未水解。
溶液变蓝 实验结论:淀粉未水解。
乙:淀粉液![]() 水解液
水解液![]() 无银镜现象 实验结论:淀粉未水解。
无银镜现象 实验结论:淀粉未水解。
丙:淀粉液![]() 水解液NaOH溶液,中和液
水解液NaOH溶液,中和液![]() 生成银镜 实验结论:淀粉完全水解。
生成银镜 实验结论:淀粉完全水解。
根据上述三个方案的操作及现象,首先回答结论是否正确,然后简要说明理由。如果三个结论均不正确,请另设计一个方案来证明淀粉已经水解完全了。
(1)方案甲:____________。
(2)方案乙:________。
(3)方案丙:___________。
(4)你的方案:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是( )
A.Na2O2溶于水:Na2O2+2H2O=2Na++2OH﹣+O2↑
B.用石墨电极电解饱和食盐水:2Cl-+2H2O=2OH-+H2↑+Cl2↑
C.用Na2CO3溶液处理锅炉水垢中的CaSO4:CaSO4+CO32-=CaCO3+SO42-
D.向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好沉淀完全:Ba2++SO42-=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷燃烧时的能量变化如图,有关说法正确的是( )

A.图1中反应为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=+890.3kJ/mol
B.图2中反应为:CH4(g)+![]() O2(g)=CO(g)+2H2O(g) H=﹣607.3kJ/mol
O2(g)=CO(g)+2H2O(g) H=﹣607.3kJ/mol
C.由图可以推得:CO(g)+![]() O2(g)=CO2(g) H=﹣283kJ/mol
O2(g)=CO2(g) H=﹣283kJ/mol
D.由图可以推知:等物质的量的CO2和CO,CO2具有的能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球上的氮元素对动植物有重要作用,其中氨的合成与应用是当前的研究热点。
(1)不同温度下工业合成氨N2(g)+3H2(g)![]() 2NH3(g)反应的部分K值如下表。
2NH3(g)反应的部分K值如下表。
温度/℃ | 25 | 400 | 450 |
K | 5×108 | 0.507 | 0.152 |
①工业合成氨反应平衡常数表达式为K=___。
②请结合平衡常数解释,该反应为放热反应的理由___。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因___。
(2)科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观示意图如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。

①阴极区生成NH3的电极方程式为___。
②下列说法不正确的是___(填字母序号)。
a.三氟甲磺酸锂的作用是增强导电性
b.该装置用金(Au)作催化剂目的是降低N2的键能
c.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。a~e是对①~⑤反应中SiO2所表现的化学性质或作用进行判断,其中正确的是
①SiO2+2NaOH=Na2SiO3+H2O
②SiO2+2C![]() Si+2CO↑
Si+2CO↑
③SiO2+4HF=SiF4↑+2H2O
④Na2CO3+SiO2![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
⑤SiO2+3C![]() SiC+2CO↑
SiC+2CO↑
a.反应①中SiO2作为玻璃的成分被消耗,用于刻蚀玻璃
b.反应②中SiO2表现出氧化性
c.反应③中SiO2表现了酸性氧化物的通性
d.反应④符合用难挥发性的酸酐制取易挥发性的酸酐的道理
e.反应⑤中SiO2未参加氧化还原反应
A.aceB.bdeC.cdeD.ab
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯水合法生产,反应的化学方程式如下:C2H4(g)+ H2O(g)![]() C2H5OH(g),下图为乙烯的平衡转化率与温度(T)、压强(P)的关系[起始n(C2H4)∶n(H2O) =1∶1]。下列有关叙述正确的是
C2H5OH(g),下图为乙烯的平衡转化率与温度(T)、压强(P)的关系[起始n(C2H4)∶n(H2O) =1∶1]。下列有关叙述正确的是
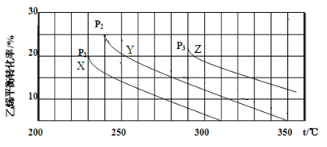
A. Y对应的乙醇的质量分数为1/9
B. X、Y、Z对应的反应速率:υ(X) > υ(Y) > υ(Z)
C. X、Y、Z对应的平衡常数数值:KX > KY > KZ
D. 增大压强、升高温度均可提高乙烯的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com