
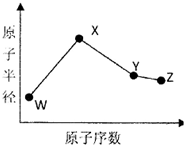
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.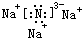 .
.| 时间 | 浓度(mo1/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
分析 W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为14,中子数为7,质子数为14-7=7,故W为氮元素;X的离子与NH4+具有相同的质子、电子数目,X的质子数为11,故X为Na元素;由图可知,X、Y、Z的原子序数依次增大,都处于第三周期,W、Y的氧化物均能导致酸雨的形成,故Y为硫元素;Z的非金属性在同周期主族元素中最强,故Z为Cl元素,据此解答.
解答 解:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为14,中子数为7,质子数为14-7=7,故W为氮元素;X的离子与NH4+具有相同的质子、电子数目,X的质子数为11,故X为Na元素;由图可知,X、Y、Z的原子序数依次增大,都处于第三周期,W、Y的氧化物均能导致酸雨的形成,故Y为硫元素;Z的非金属性在同周期主族元素中最强,故Z为Cl元素.
(1)Y为硫元素,原子有3个电子层,最外层电子数为6,处于周期表中第三周期第ⅥA族,故答案为:第三周期第ⅥA族;
(2)用电子式表示Na3N的结构为: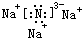 ,故答案为:
,故答案为: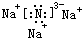 ;
;
(3)Na3N遇水可释放出使酚酞溶液变红的气体A,A为碱性气体,故A为NH3,由水解原理可知,还生成NaOH,反应化学方程式是:Na3N+3H2O=NH3↑+3NaOH,
故答案为:Na3N+3H2O=NH3↑+3NaOH;
(4)氨气与氯化氢等物质的量化合生成氯化铵溶液显酸性,现在溶液中性,说明氨气过量,所以a>b,故答案为:>;
(5)用惰性电极电解氯化钠溶液,电解NaCl溶液生成氢气、氯气、氢氧化钠,阴极发生还原反应,产生B是氢气,反应的离子方程式是::2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(6)①0min~10min,N2的浓度减小0.2mol/L,所以v(N2)=$\frac{0.2mol/L}{10min}$=0.02mol/(L•min),
故答案为:0.02mol/(L•min);
②由表中数据可知,10min~20min的速率比0min~10min速率快,10min时反应未到达平衡,反应进行向正反应进行,20min时W2、B、A的浓度变化量为分别为0.6mol/L、1.8mol/L、1.2mol/L,等于化学计量数之比,故不可能为增大某一物质浓度,增大压强反应混合物的浓度都应增大,W2、B 浓度降低,故不可能为增大压强,故10min时改变条件应是更新了催化剂或升高温度加快反应速率,故答案为:ab;
③由表中数据可知,20min时反应到达平衡,30min末又发生了一次条件改变,由40min时各组分的浓度可知,平衡向逆反应进行,30~40min之间W2、B、A的浓度变化量为分别为0.2mol/L、0.6mol/L、0.4mol/L,等于化学计量数之比,故不可能为减小某一反应物的浓度,也不可能是增大A的浓度,降低压强平衡向逆反应移动,W2、B的浓度也应该降低,故不可能为降低压强,使用催化剂,不影响平衡移动,该反应正反应为放热反应,故30min时改变条件应是升高温度,故答案为:b.
点评 本题考查元素推断、电子式、元素结构及其化合物性质、化学反应速率计算、电化学理论、溶液的酸碱性、化学平衡理论的综合应用等,难度较大,(5)中②③注意根据浓度变化结合外界条件影响解答,②中增大压强为易错点,只考虑速率加快,容易忽略浓度变化.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油和天然气的主要成分都是碳氢化合物 | |
| B. | 乙醇、乙酸和乙酸乙酯可以用饱和碳酸钠溶液鉴别 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 甘氨酸(NH2-CH2-COOH)既能与NaOH反应,又能与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O原子的电子排布图为 | |
| B. | 氯化钠的分子式:NaCl | |
| C. | Cl-的结构示意图: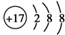 | |
| D. | Ca原子的电子排布式为 1s22s22p63s23p63d2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mo1SO2和2mol O2 | B. | 4mol SO2、2mo1 O2和2mol SO3 | ||
| C. | 4mol SO2和4 mo1 O2 | D. | 6mo1 SO2和4 mo1 O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体的熔点比金属晶体的低 | |
| B. | 在晶体中只要有阳离子,一定有阴离子 | |
| C. | 在SiO2晶体中,Si原子与Si-O键数目比为1:2 | |
| D. | 离子化合物中可能含有非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
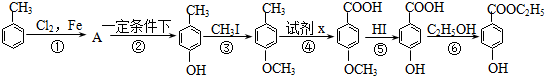
 .
.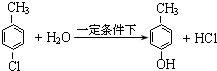 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com