
ЎҫМвДҝЎҝФӯЧУРтКэТАҙОФцҙуөДЛДЦЦФӘЛШAЎўBЎўCЎўD·ЦұрҙҰУЪөЪТ»ЦБөЪЛДЦЬЖЪЈ¬ЧФИ»ҪзЦРҙжФЪ¶аЦЦAөД»ҜәПОпЈ¬BФӯЧУәЛНвөзЧУУР6ЦЦІ»Н¬өДФЛ¶ҜЧҙМ¬Ј¬BУлCҝЙРОіЙХэЛДГжМеРО·ЦЧУЈ¬DөД»щМ¬ФӯЧУөДЧоНвДЬІгЦ»УРТ»ёцөзЧУЈ¬ЖдЛыДЬІгҫщТСідВъөзЧУЎЈЗл»ШҙрПВБРОКМвЈә
ЈЁ1Ј©ХвЛДЦЦФӘЛШЦРөзёәРФЧоҙуөДФӘЛШЈ¬Жд»щМ¬ФӯЧУөДјЫөзЧУЕЕІјНјОӘ____________________Ј¬өЪТ»өзАлДЬЧоРЎөДФӘЛШКЗ__________(МоФӘЛШ·ыәЕ)ЎЈ
ЈЁ2Ј©CЛщФЪЦчЧеөДЗ°ЛДЦЦФӘЛШ·ЦұрУлAРОіЙөД»ҜәПОпЈ¬·РөгУЙёЯөҪөНөДЛіРтКЗ___________(Мо»ҜС§КҪ)Ј¬іКПЦИзҙЛөЭұд№жВЙөДФӯТтКЗ______________________________ЎЈ
ЈЁ3Ј©BФӘЛШҝЙРОіЙ¶аЦЦөҘЦКЈ¬Т»ЦЦҫ§МеҪб№№ИзНјТ»ЛщКҫЈ¬ЖдФӯЧУөДФУ»ҜАаРНОӘ__________Ј»БнТ»ЦЦөДҫ§°ыИзНј¶юЛщКҫЈ¬ёГҫ§°ыөДҝХјдАыУГВКОӘ__________Ј¬ИфҙЛҫ§°ыЦРөДАвіӨОӘ356.6 pmЈ¬ФтҙЛҫ§°ыөДГЬ¶ИОӘ__________gЎӨcm3(ұЈБфБҪО»УРР§КэЧЦ)ЎЈ(![]() =1.732)
=1.732)

НјТ» Нј¶ю НјИэ
ЈЁ4Ј©DФӘЛШРОіЙөДөҘЦКЈ¬Ждҫ§МеөД¶С»эДЈРНОӘ__________Ј¬DөДҙЧЛбСОҫ§МеҫЦІҝҪб№№ИзНјИэЈ¬ёГҫ§МеЦРә¬УРөД»ҜС§јьКЗ__________ (МоСЎПоРтәЕ)ЎЈ
ўЩј«РФјь ўЪ·Зј«РФјь ўЫЕдО»јь ўЬҪрКфјь
ЈЁ5Ј©ПтDөДБтЛбСОИЬТәЦРөОјУ№эБҝ°ұЛ®Ј¬№ЫІмөҪөДПЦПуКЗ______________________________ЎЈ
ЗлРҙіцЙПКц№эіМөДАлЧУ·ҪіМКҪЈә__________________________________________________ЎЈ
Ўҫҙр°ёЎҝ![]() Cu HFЈҫHIЈҫHBrЈҫHCl HF·ЦЧУЦ®јдРОіЙЗвјьК№ЖдИЫ·РөгҪПёЯЈ¬HIЎўHBrЎўHCl·ЦЧУЦ®јдЦ»УР·¶өВ»ӘБҰЈ¬Па¶Ф·ЦЧУЦКБҝФҪҙуЈ¬·¶өВ»ӘБҰФҪҙуЈ» sp2 34% 3.5 ГжРДБў·ҪЧоГЬ¶С»э ўЩўЪўЫ КЧПИРОіЙА¶Й«іБөнЈ¬јМРшөОјУ°ұЛ®Ј¬іБөнИЬҪвЈ¬өГөҪЙоА¶Й«өДНёГчИЬТә Cu2++2NH3ЎӨH2O==Cu(OH)2Ўэ+NH4+ЎўCu(OH)2+4NH3==[Cu(NH3)4]2++2OH
Cu HFЈҫHIЈҫHBrЈҫHCl HF·ЦЧУЦ®јдРОіЙЗвјьК№ЖдИЫ·РөгҪПёЯЈ¬HIЎўHBrЎўHCl·ЦЧУЦ®јдЦ»УР·¶өВ»ӘБҰЈ¬Па¶Ф·ЦЧУЦКБҝФҪҙуЈ¬·¶өВ»ӘБҰФҪҙуЈ» sp2 34% 3.5 ГжРДБў·ҪЧоГЬ¶С»э ўЩўЪўЫ КЧПИРОіЙА¶Й«іБөнЈ¬јМРшөОјУ°ұЛ®Ј¬іБөнИЬҪвЈ¬өГөҪЙоА¶Й«өДНёГчИЬТә Cu2++2NH3ЎӨH2O==Cu(OH)2Ўэ+NH4+ЎўCu(OH)2+4NH3==[Cu(NH3)4]2++2OH
ЎҫҪвОцЎҝ
ФӯЧУРтКэТАҙОФцҙуөДЛДЦЦФӘЛШAЎўBЎўCЎўD·ЦұрҙҰУЪөЪТ»ЦБөЪЛДЦЬЖЪЈ¬ЧФИ»ҪзЦРҙжФЪ¶аЦЦAөД»ҜәПОпЈ¬ФтAОӘЗвФӘЛШЈ»BФӯЧУәЛНвөзЧУУР6ЦЦІ»Н¬өДФЛ¶ҜЧҙМ¬Ј¬јҙәЛНвУР6ёцөзЧУЈ¬ФтBОӘМјФӘЛШЈ»DөД»щМ¬ФӯЧУөДЧоНвДЬІгЦ»УРТ»ёцөзЧУЈ¬ЖдЛыДЬІгҫщТСідВъөзЧУЈ¬DФӯЧУНвО§өзЧУЕЕІјОӘ3d104s1Ј¬ФтDОӘНӯФӘЛШЈ»ҪбәПФӯЧУРтКэҝЙЦӘЈ¬CЦ»ДЬҙҰУЪөЪИэЦЬЖЪЈ¬BУлCҝЙРОіЙХэЛДГжМеРН·ЦЧУЈ¬ФтBОӘВИФӘЛШЎЈ
ЈЁ1Ј©ЛДЦЦФӘЛШЦРөзёәРФЧоҙуөДКЗClЈ¬Жд»щМ¬ФӯЧУөДјЫөзЧУКэОӘ7Ј»ҪрКфРФФҪЗҝЈ¬өЪТ»өзАлДЬФҪРЎЈ»
ЈЁ2Ј©HF·ЦЧУјдҙжФЪЗвјьЈ¬·РөгЧоёЯЈ¬ЖдЛьВұ»ҜЗвЛжЧЕПа¶Ф·ЦЧУЦКБҝөЭФцЈ¬Жд·РөгЙэёЯЈ»
ЈЁ3Ј©НјТ»ОӘЖҪГжҪб№№Ј¬ФЪЖдІгЧҙҪб№№ЦРМјМјјьјьҪЗОӘ120ЎгЈ¬ГҝёцМјФӯЧУ¶јҪбәПЧЕ3ёцМјФӯЧУЈ¬МјФӯЧУІЙИЎsp2ФУ»ҜЈ»јЖЛгҫ§°ыЦРМјФӯЧУЧЬМе»эУлҫ§°ыөДМе»эЈ¬ід·ЦАыУГҫ§°ыЦРГҝёцCФӯЧУУлЦЬО§4ёцCФӯЧУРОіЙХэЛДГжМеҪб№№Ј¬И·¶Ёҫ§°ыАвіӨУлCФӯЧУ°лҫ¶№ШПөЈ»ёщҫЭҫщМҜ·ЁјЖЛгҫ§°ыЦРCФӯЧУКэДҝЈ¬Ҫш¶шјЖЛгҫ§°ыЦКБҝЈ¬ФЩёщҫЭҫ§°ыГЬ¶И=ЦКБҝ/Ме»эјЖЛгЈ»
ЈЁ4Ј©ҫ§МеCuОӘГжРДБў·ҪЧоГЬ¶С»эЈ¬ҪбәПНјИэҙЧЛбНӯҫ§МеөДҫЦІҝҪб№№ҝЙИ·¶ЁЖдҫ§МеЦРә¬УРј«РФјьЎў·Зј«РФјьәНЕдО»јьЈ»
ЈЁ5Ј©БтЛбНӯИЬТәЦРјУИл°ұЛ®»бІъЙъЗвСх»ҜНӯА¶Й«іБөнЈ¬јМРшөОјУ°ұЛ®Ј¬іБөнИЬҪвЈ¬өГөҪЛД°ұәПНӯВзАлЧУЈ¬ИЬТәОӘЙоА¶Й«өДНёГчИЬТәЎЈ
ФӯЧУРтКэТАҙОФцҙуөДЛДЦЦФӘЛШAЎўBЎўCЎўD·ЦұрҙҰУЪөЪТ»ЦБөЪЛДЦЬЖЪЈ¬ЧФИ»ҪзЦРҙжФЪ¶аЦЦAөД»ҜәПОпЈ¬ФтAОӘЗвФӘЛШЈ»BФӯЧУәЛНвөзЧУУР6ЦЦІ»Н¬өДФЛ¶ҜЧҙМ¬Ј¬јҙәЛНвУР6ёцөзЧУЈ¬ФтBОӘМјФӘЛШЈ»DөД»щМ¬ФӯЧУөДЧоНвДЬІгЦ»УРТ»ёцөзЧУЈ¬ЖдЛыДЬІгҫщТСідВъөзЧУЈ¬DФӯЧУНвО§өзЧУЕЕІјОӘ3d104s1Ј¬ФтDОӘНӯФӘЛШЈ»ҪбәПФӯЧУРтКэҝЙЦӘЈ¬CЦ»ДЬҙҰУЪөЪИэЦЬЖЪЈ¬BУлCҝЙРОіЙХэЛДГжМеРН·ЦЧУЈ¬ФтBОӘВИФӘЛШЎЈ
ЈЁ1Ј©ЛДЦЦФӘЛШЦРөзёәРФЧоҙуөДКЗClЈ¬Жд»щМ¬ФӯЧУөДјЫөзЧУКэОӘ7Ј¬Жд»щМ¬ФӯЧУөДјЫөзЧУЕЕІјНјОӘ![]() Ј»ЛДФӘЛШЦРCuөДҪрКфРФФҪЗҝЈ¬№КCuөДөЪТ»өзАлДЬФҪРЎЈ¬
Ј»ЛДФӘЛШЦРCuөДҪрКфРФФҪЗҝЈ¬№КCuөДөЪТ»өзАлДЬФҪРЎЈ¬
№Кҙр°ёОӘЈә![]() Ј»CuЎЈ
Ј»CuЎЈ
ЈЁ2Ј©HF·ЦЧУЦ®јдРОіЙЗвјьК№ЖдИЫ·РөгҪПёЯЈ¬HIЎўHBrЎўHCl·ЦЧУЦ®јдЦ»УР·¶өВ»ӘБҰЈ¬Па¶Ф·ЦЧУЦКБҝФҪҙуЈ¬·¶өВ»ӘБҰФҪҙуЈ¬·РөгФҪёЯЈ¬јҙ·РөгУЙёЯөҪөНөДЛіРтКЗHFЈҫHIЈҫHBrЈҫHClЈ¬
№Кҙр°ёОӘЈәHFЈҫHIЈҫHBrЈҫHClЈ»HF·ЦЧУЦ®јдРОіЙЗвјьК№ЖдИЫ·РөгҪПёЯЈ¬HIЎўHBrЎўHCl·ЦЧУЦ®јдЦ»УР·¶өВ»ӘБҰЈ¬Па¶Ф·ЦЧУЦКБҝФҪҙуЈ¬·¶өВ»ӘБҰФҪҙуЎЈ
ЈЁ3Ј©НјТ»ОӘЖҪГжҪб№№Ј¬ФЪЖдІгЧҙҪб№№ЦРМјМјјьјьҪЗОӘ120ЎгЈ¬ГҝёцМјФӯЧУ¶јҪбәПЧЕ3ёцМјФӯЧУЈ¬МјФӯЧУІЙИЎsp2ФУ»ҜЈ»ҫ§°ыЦРГҝёцCФӯЧУУлЦЬО§4ёцCФӯЧУРОіЙХэЛДГжМеҪб№№Ј¬ИзНјЛщКҫЈә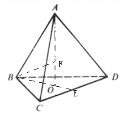
БоМјФӯЧУ°лҫ¶ОӘrЈ¬ФтFAіӨ=2rЈ¬ёщҫЭМе»э№ШПөҝЙЦӘЈ¬AOіӨ=4OFіӨЈ¬№КFAіӨ=3OFіӨЈ¬№КAOіӨ=![]() Ј¬ЙиBCіӨОӘaЈ¬BOіӨ=
Ј¬ЙиBCіӨОӘaЈ¬BOіӨ=![]() Ј¬ФтOAіӨ=
Ј¬ФтOAіӨ=![]() Ј¬№КЈЁ6Ј©1/2/3a=8/3rЈ¬№Кa=
Ј¬№КЈЁ6Ј©1/2/3a=8/3rЈ¬№Кa=![]() Ј¬Фтҫ§°ыАвіӨ=
Ј¬Фтҫ§°ыАвіӨ=![]() Ј¬Фтҫ§°ыМе»э=
Ј¬Фтҫ§°ыМе»э=![]() Ј¬ҫ§°ыЦРCФӯЧУКэДҝ=4+6ЎБ1/2+8ЎБ1/8=8Ј¬Фтҫ§°ыЦРМјФӯЧУЧЬМе»э=8ЎБ4/3ҰРr3Ј¬№Кҫ§°ыҝХјдАыУГВК=ЈЁ8ЎБ43ҰРr3Ј©ЎВ[8/3ЎБЈЁ3Ј©1/2r]3=34%Ј»Т»ёцҫ§°ыЦРә¬МјФӯЧУКэОӘ8ЎБ1/8+6ЎБ1/2+4=8Ј¬ҫ§°ыЦКБҝ=8ЎБ12/6.02ЎБ1023gЈ¬ҫ§°ыЦРөДАвіӨОӘ356.6pmЈ¬Фтҫ§°ыМе»э=ЈЁ8ЎБ12/6.02ЎБ1023gЈ©ЎВЈЁ356.6ЎБ10-10cmЈ©3ЎЦ3.5gЎӨcm-3Ј¬
Ј¬ҫ§°ыЦРCФӯЧУКэДҝ=4+6ЎБ1/2+8ЎБ1/8=8Ј¬Фтҫ§°ыЦРМјФӯЧУЧЬМе»э=8ЎБ4/3ҰРr3Ј¬№Кҫ§°ыҝХјдАыУГВК=ЈЁ8ЎБ43ҰРr3Ј©ЎВ[8/3ЎБЈЁ3Ј©1/2r]3=34%Ј»Т»ёцҫ§°ыЦРә¬МјФӯЧУКэОӘ8ЎБ1/8+6ЎБ1/2+4=8Ј¬ҫ§°ыЦКБҝ=8ЎБ12/6.02ЎБ1023gЈ¬ҫ§°ыЦРөДАвіӨОӘ356.6pmЈ¬Фтҫ§°ыМе»э=ЈЁ8ЎБ12/6.02ЎБ1023gЈ©ЎВЈЁ356.6ЎБ10-10cmЈ©3ЎЦ3.5gЎӨcm-3Ј¬
№Кҙр°ёОӘЈәsp2Ј»34%Ј»3.5ЎЈ
ЈЁ4Ј©ҫ§МеCuОӘГжРДБў·ҪЧоГЬ¶С»эЈ¬ҪбәПНјИэҙЧЛбНӯҫ§МеөДҫЦІҝҪб№№ҝЙИ·¶ЁЖдҫ§МеЦРә¬УРј«РФјьЎў·Зј«РФјьәНЕдО»јьЈ¬
№Кҙр°ёОӘЈәГжРДБў·ҪЧоГЬ¶С»эЈ»ўЩўЪўЫЎЈ
ЈЁ5Ј©БтЛбНӯИЬТәЦРјУИл°ұЛ®»бІъЙъА¶Й«іБөнЈ¬јМРшөОјУ°ұЛ®Ј¬іБөнИЬҪвЈ¬өГөҪЙоА¶Й«өДНёГчИЬТәЈ¬УР№Ш·ҙУҰөДАлЧУ·ҪіМКҪОӘCu2++2NH3ЎӨH2OЁTCuЈЁOHЈ©2Ўэ+2NH4+ЎўCuЈЁOHЈ©2+4NH3ЁT[CuЈЁNH3Ј©4]2++2OH-Ј¬
№Кҙр°ёОӘЈәКЧПИРОіЙА¶Й«іБөнЈ¬јМРшөОјУ°ұЛ®Ј¬іБөнИЬҪвЈ¬өГөҪЙоА¶Й«өДНёГчИЬТәЈ»Cu2++2NH3ЎӨH2OЁTCuЈЁOHЈ©2Ўэ+2NH4+ЎўCuЈЁOHЈ©2+4NH3ЁT[CuЈЁNH3Ј©4]2++2OH-ЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУРAЎўBБҪёцНкИ«ПаН¬өДЧ°ЦГЈ¬ДіС§Йъ·ЦұрФЪЛьГЗөДІа№ЬЦРЧ°Ил1.06g Na2CO3әН0.84g NaHCO3Ј¬AЎўBЦР·ЦұрУР10mLПаН¬ЕЁ¶ИөДСОЛбЈ¬Ҫ«БҪёцІа№ЬЦРөДОпЦКН¬Кұө№ИлёчЧФөДКФ№ЬЦРЈ¬ПВБРРрКцХэИ·өДКЗЈЁ Ј©

A.BЧ°ЦГөДЖшЗтЕтХНөДМе»эҙу
B.ЧоЦХБҪКФ№ЬЦРNaClөДОпЦКөДБҝТ»¶ЁПаН¬
C.ИфЧоЦХБҪЖшЗтМе»эІ»Н¬Ј¬ФтСОЛбөДЕЁ¶ИТ»¶ЁРЎУЪ»төИУЪ1mol/L
D.ИфЧоЦХБҪЖшЗтМе»эПаН¬Ј¬ФтСОЛбөДЕЁ¶ИТ»¶ЁҙуУЪ»төИУЪ2mol/L
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіН¬С§ТӘФЪ°ВФЛОеБ¬»·ЦРМоИлОпЦКЈ¬К№ПаБ¬ОпЦКјдДЬ·ўЙъ·ҙУҰЈ¬І»ПаБ¬ОпЦКјдІ»ДЬ·ўЙъ·ҙУҰЎЈДгИПОӘЎ°ОеБ¬»·ЎұЦРУРҝХИұөДТ»»·УҰМоИлөДОпЦККЗ(ЎЎЎЎ)

A. БтЛб B. СхЖш C. ¶юСх»ҜМј D. Сх»ҜёЖ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘ·ҙУҰH2ЈЁgЈ©+ I2ЈЁgЈ©![]() 2HIЈЁgЈ©Ј¬1 mol H2НкИ«·ҙУҰ·Еіцa kJөДИИБҝЈ¬ТАҫЭПВұнКэҫЭЈ¬ТФПВЛө·ЁҙнОуөДКЗЈЁ Ј©
2HIЈЁgЈ©Ј¬1 mol H2НкИ«·ҙУҰ·Еіцa kJөДИИБҝЈ¬ТАҫЭПВұнКэҫЭЈ¬ТФПВЛө·ЁҙнОуөДКЗЈЁ Ј©
»Ҝ С§ јь | HЎӘH | IЎӘI |
¶ПҝӘ1 mol»ҜС§јьКұОьКХөДДЬБҝЈЁkJЈ© | b | c |
AЈ®ёГ·ҙУҰЦР·ҙУҰОпөДЧЬДЬБҝёЯУЪЙъіЙОпөДЧЬДЬБҝ
BЈ®¶ПҝӘ1 mol H-H јьәН1 mol I-I јьЛщРиДЬБҝҙуУЪ¶ПҝӘ2 mol H-I јьЛщРиДЬБҝ
CЈ®¶ПҝӘ2 mol H-IјьЛщРиДЬБҝОӘЈЁa+b+cЈ©kJ
DЈ®ПтГЬұХИЭЖчЦРјУИл2 mol H2әН2 mol I2Ј¬ід·Ц·ҙУҰәу·ЕіцөДИИБҝРЎУЪ2a kJ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіКөСйРЎЧйН¬С§АыУГПВНјЧ°ЦГ¶Фөз»ҜС§ФӯАнҪшРРБЛТ»ПөБРМҪҫҝ»о¶ҜЎЈ

ЈЁ1Ј©јЧіШОӘЧ°ЦГ_______(МоЎ°ФӯөзіШЎұ»тЎ°өзҪвіШЎұ)ЎЈ
ЈЁ2Ј©јЧіШ·ҙУҰЗ°Ј¬БҪөзј«ЦКБҝПаөИЈ¬Т»¶ОКұјдәуЈ¬БҪөзј«ЦКБҝПаІо28gЈ¬өјПЯЦРНЁ№э_________molөзЧУЎЈ
ЈЁ3Ј©КөСй№эіМЦРЈ¬јЧіШЧуІаЙХұӯЦРNO3-өДЕЁ¶И_______(МоЎ°ұдҙуЎұЎўЎ°ұдРЎЎұ»тЎ°І»ұдЎұ)ЎЈ
ЈЁ4Ј©ЖдЛыМхјюІ»ұдЈ¬ИфУГUРОНӯ°фҙъМжЎ°СОЗЕЎұЈ¬№ӨЧчТ»¶ОКұјдәуИЎіцНӯ°фіЖБҝЈ¬ЦКБҝ___________(МоЎ°ұдҙуЎұЎўЎ°ұдРЎЎұ»тЎ°І»ұдЎұ)ЎЈИфТТіШЦРөДДіСОИЬТәКЗЧгБҝAgNO3ИЬТәЈ¬ФтТТіШЦРЧуІаPtөзј«·ҙУҰКҪОӘ___________________________________Ј¬№ӨЧчТ»¶ОКұјдәуЈ¬ИфТӘК№ТТіШИЬТә»ЦёҙФӯАҙЕЁ¶ИЈ¬ҝЙПтИЬТәЦРјУИл_____________(Мо»ҜС§КҪ)ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУГҫЖҫ«өЖјУИИПВБРИЬТәЈ¬ХфёЙәуЧЖЙХЈ¬ЛщөГ№ММеЦКБҝЧоҙуөДКЗ(ЎЎЎЎ)
A. 20 mL 2 mol/L FeCl3ИЬТә B. 40 mL 1 mol/L NaHCO3ИЬТә
C. 20 mL 1 mol/L Na2SO3ИЬТә D. 40 mL 2 mol/L NH4HCO3ИЬТә
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУГNAұнКҫ°ў·ьјУөВВЮіЈКэөДКэЦөЎЈПВБРЛө·ЁХэИ·өДКЗ
A. 1. 0molЎӨL-1 AlCl3өДИЬТәЦРә¬Al3+өДКэДҝРЎУЪ0. 1NA
B. 0. 5mol»·јәНйЦРә¬·Зј«РФјьөДКэДҝОӘ2. 5NA
C. 30gУЙЖПМСМЗәНИйЛб(C3H6O3)ЧйіЙөД»мәПОпЦРә¬ЗвФӯЧУКэДҝОӘ2NA
D. 7. 1g Cl2НкИ«·ҙУҰЧӘТЖөДөзЧУКэТ»¶ЁОӘ0. 2NA
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЙиNAОӘ°ў·ьЩӨөВВЮіЈКэөДЦөЎЈПВБРЛө·ЁХэИ·өДКЗ
A. ұкЧјЧҙҝцПВЈ¬22.4 L C2H6Oә¬УРөДO-HјьКэДҝОӘNA
B. 100 g ЦКБҝ·ЦКэ17%H2O2ИЬТәЦРј«РФјьКэДҝОӘNA
C. 65 g ZnУлЧгБҝЕЁБтЛбід·Ц·ҙУҰөГ»мәПЖшМеөД·ЦЧУКэОӘNA
D. 1 L 0.1 mol/L K2Cr2O7ИЬТәЦРә¬ёхөДАлЧУЧЬКэОӘ0.2NA
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ2SO2Ј«O2![]() 2SO3КЗ№ӨТөЦЖБтЛбөДТ»ІҪЦШТӘ·ҙУҰЈ¬ПВБРЛө·ЁХэИ·өДКЗ
2SO3КЗ№ӨТөЦЖБтЛбөДТ»ІҪЦШТӘ·ҙУҰЈ¬ПВБРЛө·ЁХэИ·өДКЗ
A. К№УГҙЯ»ҜјБДЬёДұдёГ·ҙУҰПЮ¶И
B. јхРЎSO2өДЕЁ¶ИДЬјУҝмёГ·ҙУҰөДЛЩВК
C. ЙэёЯМеПөОВ¶ИДЬјУҝм·ҙУҰЛЩВК
D. 1 mol SO2әНЧгБҝөДO2ФЪТ»¶ЁМхјюПВід·Ц·ҙУҰЈ¬ЙъіЙ1 mol SO3
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com