
【题目】铋(Bi)的无毒与不致癌性有很多特殊用途,其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如下:

已知:①25℃时,K sp(FeS)=6.0×10-18 K sp(PbS)=3.0×10-28
K sp(Bi2S3)=1.6×10-20
②溶液中的离子浓度小于等于10-5mol L-1时,认为该离子沉淀完全。
(1)Bi位于元素周期表第六周期,与N、P同族,Bi的原子结构示意图为________。
(2)“浸出”时Bi2S3与FeCl3溶液反应的化学方程式为___________________;反应液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是________(用离子方程式表示)。
(3)“母液1”中通入气体X后可循环利用,气体X的化学式为________。
(4)“粗铋”中含有的杂质主要是Pb,通过熔盐电解精炼可达到除杂的目的,其装置如右图。电解后,阳极底部留下的为精铋。阳极材料为____________,阴极的电极反应式为________________。

(5)碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是________。“母液2”中可回收的主要物质是________。
(6)25℃时,向浓度均为0.1mol·L-1的Fe2+、Pb2+、Bi3+的混合溶液中滴加Na2S溶液,当Pb2+恰好沉淀完全时,所得溶液中c(Fe2+):c(Bi3+)=__________________
【答案】 ![]() 6FeCl3+Bi2S3=2BiCl3+6FeCl2+3S Bi3++H2O+Cl-=BiOCl↓+H+ Cl2 粗铋 Pb2++2e-=Pb 没有污染性气体产生 NH4NO3 1:1
6FeCl3+Bi2S3=2BiCl3+6FeCl2+3S Bi3++H2O+Cl-=BiOCl↓+H+ Cl2 粗铋 Pb2++2e-=Pb 没有污染性气体产生 NH4NO3 1:1
【解析】辉铋矿(主要成分是Bi2S3.还含少量Bi2O3,SiO2等杂质)制备Bi2O3,辉铋矿加入氯化铁溶液和盐酸溶解后过滤,氯化铁氧化硫离子为硫单质,盐酸是防止FeCl3及BiCl3水解生成不溶性沉淀,得到滤渣为SiO2和S,浸出液中含有Bi3+,H+,Fe2+,浸出液中加入铁粉过滤得到粗铋,和母液1主要是氯化亚铁;粗铋精炼后得到精铋,精铋用硝酸溶解后,再加入(NH4)2CO3,得到碱式碳酸铋,和母液2,主要含有硝酸铵,碱式碳酸铋煅烧生成Bi2O3。
(1)Bi位于元素周期表第六周期,与N、P同族,最外层有5个电子,Bi的原子结构示意图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)“浸出”时Bi2S3与FeCl3溶液反应的化学方程式为6FeCl3+Bi2S3=2BiCl3+6FeCl2+3S;反应液必须保持强酸性,否则铋离子水解生成BiOCl(碱式氯化铋),使产率降低,离子方程式为Bi3++H2O+Cl-=BiOCl↓+H+,故答案为:6FeCl3+Bi2S3=2BiCl3+6FeCl2+3S ;Bi3++H2O+Cl-=BiOCl↓+H+;
(3) “母液1” 主要是氯化亚铁,通入氯气后生成氯化铁,然后循环使用,故答案为:Cl2;
(4)“粗铋”中含有的杂质主要是Pb,通过熔盐电解精炼可达到除杂的目的,电解后,阳极底部留下的为精铋。电解精炼时,粗铋作阳极,阳极上发生氧化反应,Pb放电变成Pb2+进入溶液,阴极上发生还原反应,电极反应式为Pb2++2e-=Pb,故答案为:粗铋;Pb2++2e-=Pb;
(5)碱式硝酸铋直接灼烧得到Bi2O3、二氧化碳和水,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是没有污染性气体产生;“母液2”中含有NH4NO3,可回收利用,故答案为:没有污染性气体产生;NH4NO3;
(6)25℃时,向浓度均为0.1mol·L-1的Fe2+、Pb2+、Bi3+的混合溶液中滴加Na2S溶液,当Pb2+恰好沉淀完全时,c(S2-)=![]() =
=![]() = 3.0×10-23,根据Ksp(FeS)=6.0×10-18 ,Ksp(Bi2S3)=1.6×10-20可知,当c(S2-)= 3.0×10-23时,Fe2+和Bi3+还没有开始沉淀,溶液中c(Fe2+):c(Bi3+)= 0.1mol·L-1:0.1mol·L-1=1:1,故答案为:1:1。
= 3.0×10-23,根据Ksp(FeS)=6.0×10-18 ,Ksp(Bi2S3)=1.6×10-20可知,当c(S2-)= 3.0×10-23时,Fe2+和Bi3+还没有开始沉淀,溶液中c(Fe2+):c(Bi3+)= 0.1mol·L-1:0.1mol·L-1=1:1,故答案为:1:1。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】下列各组元素的性质递变情况错误的是
A. N、O、F原子最外层电子数依次增加
B. N、O、F原子半径依次增大
C. Na、Mg、Al元素最高正化合价依次升高
D. Li、Na、K的金属性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由锌、铁、铝、镁四种金属中的两种组成的混合物23g,与足量的盐酸反应产生的氢气标准状况下为22.4L,则两种金属组成的混合物可能是( )
A. 锌与镁 B. 铁与锌 C. 铝与铁 D. 镁与铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种兴奋剂的结构简式如右图所示,有关该物质的说法错误的是

A.该有机物不仅能使溴水、酸性 KMnO4 溶液褪色,也能与FeCl3溶液发生显色反应
B.一定条件下该有机物能发生加成反应、氧化反应、取代反应,也能发生聚合反应
C.该有机物中可能存在手性碳原子
D.该有机物显弱酸性,能与 NaOH 溶液、NaHCO3 溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲烷为燃料的新型电池得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。下列说法错误的是

A. 以甲烷为燃料,其成本大大低于以氢气为燃料的传统燃料电池
B. A电极为电池正极,发生还原反应
C. B电极反应式为CH4+4O2--8e-===CO2+2H2O
D. 若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L-1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为22.4L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与水解反应无关的是:
A. 配制CuSO4溶液时加少量稀H2SO4B. 用热的Na2CO3溶液去油污
C. 明矾净水D. 用Na2S除去废水中的Hg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I下图表示一些晶体中的某些结构,他们分别是氯化钠、氯化铯、干冰、金刚石、石墨结构中的某一种的某一部分(黑点可表示不同或相同的粒子)。

(1)其中代表金刚石的是_______(填编号字母,下同),金刚石中每个碳原子与_____个碳原子最接近且距离相等。
(2)其中代表石墨的是________,其中每个正六边形占有的碳原子数平均为________个;
(3)其中表示氯化钠的是___,每个钠离子周围与它最接近且距离相等的钠离子有___个;
(4)代表氯化铯的是______,每个铯离子与______个氯离子紧邻;
(5)代表干冰的是_______,每个二氧化碳分子与________个二氧化碳分子紧邻;
II将少量CuSO4粉末溶于盛有水的试管中得到一种天蓝色溶液,先向试管里的溶液中滴加氨水,首先形成蓝色沉淀。继续滴加氨水,沉淀溶解,得到深蓝色溶液;再加入乙醇溶剂,将析出深蓝色的晶体。
(1)溶液中呈天蓝色微粒的化学式是______,1 mol该天蓝色微粒所含的σ键数目为______。
(2)加入乙醇的作用是_____________________。
(3)写出蓝色沉淀溶解成深蓝色溶液的离子方程式______________。
(4)得到的深蓝色晶体是[Cu(NH3)4]SO4·H2O,晶体中Cu2+与NH3之间的化学键类型为_____, 该晶体中配体分子的空间构型为_________。(用文字描述)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐在化学工业中有重要的应用,请回答下列问题
(1)用离子方程式表示FeCl3可作净水剂的原因:___________________ 。
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为_____ , 向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体,其离子方程式为:_________________。
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是__________ (用序号表示)
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是 _______
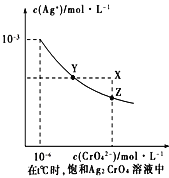
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01molL-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是_______。(当离子浓度小于1×10-5mol/L时,认为完全沉淀)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向10L容积不变的密闭容器中加入1.0molNH2COONH4,发生反应NH2COONH4(s)![]() CO2(g)+2NH3(g) ΔH>0。5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是
CO2(g)+2NH3(g) ΔH>0。5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是
A. 0~5min内,v(CO2)=0.16mol·L-1·min-1
B. 氨气体积分数不变时,该反应一定达到平衡状态
C. 平衡后,缩小容器容积,重新建立平衡时,c(CO2)增大
D. 其他条件不变,若将原容器改为绝热容器,则达到平衡时,NH2COONH4的转化率小于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com