
【题目】下列物质互为同分异构体的是( )。
A. 12C和14CB. CH4和C2H6
C. C2H5OH和CH3OCH3D. O2和O3
科目:高中化学 来源: 题型:
【题目】三种常见单萜类化合物的结构如下图所示。下列说法正确的是( )

A. 香叶醇和龙脑互为同分异构体,分子式均为![]()
B. 可用金属钠鉴别香叶醇和月桂烯
C. 龙脑分子中所有碳原子在同一个平面上
D. 1mol月桂烯最多能与![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图,下列分析正确的是( )

A. B点的横坐标a=12.5
B. C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C. D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D. 曲线上A、B间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈________(填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+)______c(CH3COO-)(填“>”、“=”或“<”,下同)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)
(3)常温下将0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)________0.2 mol·L-1 HCl溶液中由水电离出的c(H+)。(填“>”、“<”或“=”,下同)
(4)常温下若将0.2 mol·L-1MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度________MCl的水解程度。
(5)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH________。(填“>7”、“<7”或“无法确定”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体工业会产生含氨氟酸的废水。完成下列填空:
(1)为了测定某含氢氟酸的废水中HF浓度,量取25.00 mL废水,滴入2~3滴酚酞试液,用0.0100 mol/L标准NaOH溶液滴定,用去26.00 mL。滴定终点的判断方法是_______________________。废水中的c(HF) =_________mol/L。 (精确到 0.0001)
(2)工业上用石灰乳处理含氢氟酸的废水,处理时要控制反应池中呈碱性,目的是_______。
(3)用石灰乳处理含氢氟酸的废水时,会得到含氟底泥(主要含CaF2、CaCO3、CaSO4),含氟底泥可用于制取氟化钙,其生产流程如下:

已知:氟化钙难溶于水,微溶于无机酸。
①“沉淀转化”的目的是将CaSO4转化为CaCO3,试从平衡移动的角度分析,沉淀能够转化的原理。____________________________________________________________。
②酸洗是为了除去CaCO3,酸洗时发生反应的离子方程式为______________________。
③最终得到的产品质量比底泥中CaF2的质量__________ (填“多"、“少”或“相等”),理由是____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水是一项重要的化学工业,请完成下列计算:
(1)当电解产生0.2molNaOH时,能收集到标准状况下的H2____L。
(2)已知室温时饱和食盐水的溶质质量分数为0.265,取200g饱和食盐水进行电解,当NaCl反应了一半时停止电解,
①求出所得混合溶液中NaCl的质量。_____
②求出所得混合溶液中NaOH的质量分数。____(写出计算过程,保留3位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成乳酸(![]() )的一种途径如下:
)的一种途径如下:
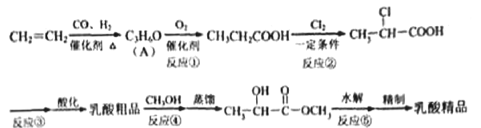
完成下列填空:
(1) 乳酸中的官能团名称是___________ 。A 的结构简式是___________。
(2)反应②的反应类型是___________。反应③的条件是___________。
(3)反应④的化学方程式为____________________________________________。
(4)聚乳酸是一种常用的可降解塑料,由乳酸聚合得到,其结构如下:

聚乳酸降解时,会产生自催化效应(降解的速度会越来越快) ,请解释原因__________。
(5)设计一条由丙烯制备丙酸的合成路线 _____________________ 。
(合成路线常用的表示方式为:A ![]() B ... ...
B ... ... ![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为1~18号元素内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。
(1)写出元素符号:W为____,X为____,Y为____,Z为____。
(2)X的原子结构示意图为__________,Y___________(填“得到”或“失去”)电子时,形成的离子结构示意图为________________;Z得到电子,形成的阴离子的电子式为_____________.
(3)由X、Y、Z形成的一种化合物的电离方程式______________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com