
【题目】W、X、Y、Z为1~18号元素内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。
(1)写出元素符号:W为____,X为____,Y为____,Z为____。
(2)X的原子结构示意图为__________,Y___________(填“得到”或“失去”)电子时,形成的离子结构示意图为________________;Z得到电子,形成的阴离子的电子式为_____________.
(3)由X、Y、Z形成的一种化合物的电离方程式______________________.
【答案】H O Na S ![]() 失去
失去 ![]()
![]() Na2SO4→2Na++SO42-/ Na2SO3→2Na++SO32-
Na2SO4→2Na++SO42-/ Na2SO3→2Na++SO32-
【解析】
短周期的金属只有Li、Be、Na、Mg、Al,Y和W的最外层电子数相等即W和Y同族,所以W只能是H(氢);因不存在稀有气体,所以如果Y是Li,X就成了稀有气体,不成立,所以Y是Na,Y的质子数是11,W的质子数是1,X的质子数有可能是5,6,7,8,9;Y+Z就应该有18,21,24、27,30等可能,但Z一定大于Y,也就是12以上,算到最大的短周期元素Cl也只有17,加起来是28,那么Y+Z就一定小于等于28,28不是3的倍数,有24,27两解:1,7,11,13(铝)不成立,1,8,11,16 成立,所以W、X、Y、Z分别为:H,O,Na,S;
(1)根据以上分析可知,W、X、Y、Z分别为:H、O、Na、S;
(2) X的原子结构示意图为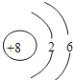 ,
,
Y是Na最外层有1个电子,已失去电子1个电子,形成的离子结构示意图为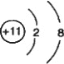
Z得到电子,形成的阴离子的电子式为![]()
(3)由X、Y、Z形成的一种化合物是Na2SO4或者Na2SO3电离方程式为
Na2SO4→2Na++SO42-/ Na2SO3→2Na++SO32-


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】闪电时空气中有臭氧生成。下列说法正确的是( )
A.![]() 和
和![]() 互为同位素
互为同位素
B.![]() 与
与![]() 的相互转变是物理变化
的相互转变是物理变化
C.相同状况下,等体积![]() 和
和![]() 含有相同质子数
含有相同质子数
D.![]() 比
比![]() 氧化性更强
氧化性更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾(CuSO45H2O)配制0.1 molL-1的硫酸铜溶液,正确的操作是( )
A. 将胆矾加热除去结晶水后,称取16g溶解在1 L水中
B. 称取25 g胆矾溶于水,然后将此溶液稀释至1 L
C. 称取25 g胆矾溶解在1 L水里
D. 将16 g胆矾溶于水,然后将此溶液稀释至1 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g)![]() H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
A.升高温度 B.加入催化剂
C.再加入n molCO和n molH2O D.再加入2n molCO2和2n molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式次氯酸镁[Mg2ClO(OH)3·H2O]微溶于水,是一种无机抗菌剂。某研发小组通过下列流程制备碱式次氯酸镁:

⑴从上述流程可以判断,滤液中可回收的主要物质是______。
⑵调pH时若条件控制不当,会使得所制的碱式次氯酸镁中混有Mg(OH)2杂质。为防止生成该杂质,实验中可以采取的方法是______。
⑶为测定碱式次氯酸镁的质量分数[含少量Mg(OH)2杂质],现进行如下实验:称取0.2000g碱式次氯酸镁样品,将其溶于足量硫酸。向溶液中加入过量KI,再用0.1000 mol·L-1 Na2S2O3滴定生成的I2,恰好完全反应时消耗Na2S2O3溶液体积为20.00 mL。计算碱式次氯酸镁的质量分数。(写出计算过程)______________
已知:2I-+ClO-+2H+=I2+Cl-+H2O,I2+2S2O32-=2I-+S4O62-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1999年曾报导合成和分离了含高能量的正离子N5+ 的化合物N5AsF6,下列说法正确的是( )
A. 其中只含有共价键,是共价化合物B. 其中只含有离子键,是离子化合物
C. 其中既有离子键,又有共价键,是离子化合物D. 以上说法都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q kJ |
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 平衡时,两容器中CO2的浓度相等
D. 容器①时CO的反应速率等于H2O的反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com