
【题目】室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25 ℃其溶度积为2.8×10-9 mol2/L2,下列说法不正确的是
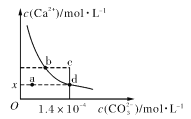
A. x数值为2×10-5
B. c点时有碳酸钙沉淀生成
C. 加入蒸馏水可使溶液由d点变到a点
D. b点与d点对应的溶度积相等
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】关于石油和石油化工的说法错误的是
A. 石油大体上是由各种碳氢化合物组成的混合物
B. 石油分馏得到的各馏分是由各种碳氢化合物组成的混合物
C. 石油裂解和裂化的主要目的都是为了得到重要产品乙烯
D. 实验室里,在氧化铝粉末的作用下,用石蜡可以制出汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是国际七个基本物理量之一 B.阿伏伽德罗常数是没有单位的
C.氮气的摩尔质量是28g D.1molH2O约含有6.02×1023个水分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室保存下列化学试剂的方法不正确的是( )
A.新制氯水放在棕色试剂瓶中,避光保存
B.液溴密封盛放在棕色瓶中,液面上放一层水
C.少量金属钠保存在四氯化碳中
D.水玻璃保存在带胶塞的玻璃试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在向盛有氯化铁溶液的烧杯中加入过量铜粉,反应结束后过滤,对溶液中大量存在的金属阳离子的成分判断正确的是( )
A.只有Cu2+
B.Fe2+、Cu2+
C.Fe3+、Fe2+
D.Fe3+、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应 :2NaClO2 + Cl2 ===2ClO2 + 2NaCl。
下图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。

(1)仪器P的名称是______________________。
(2)写出装置A中烧瓶内发生反应的离子方程式:_____________________。
(3)B装置中所盛试剂是____________________。
(4)F为ClO2收集装置,应选用的装置是______________(填序号),其中与E装置导管相连的导管口是__________(填接口字母)。

(5)若用100 mL 2 mol·L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是________(填序号)。
A.>0.1 mol B.0.1 mol C.<0.1 mol D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.5L 0.4mol/L的NaClO溶液中缓慢通入0.1mol CO2根据右表提供的数据,下列判断不正确的是
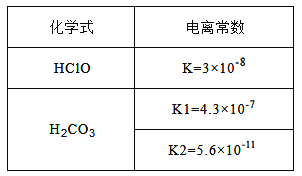
A. 原溶液中:c(ClO-)>c(OH-)>c(H+)
B. 原溶液中c(OH-)=c(H+)+c(HClO)
C. 反应后溶液中c(HClO)>c(HCO3-)>c(ClO-)>c(CO32-)
D. 反应后溶液中c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)+c(ClO-)+c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选用甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,判断滴定终点的现象是__________________。
(2)下列操作中可能使所测NaOH溶液的浓度偏低的是______。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
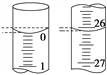
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为________mL。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.31 | 26.31 |
第二次 | 25.00 | 1.56 | a | 28.74 |
第三次 | 25.00 | 0.22 | 26.51 | b |
表格中a的数值为_________, b的数值为_________。
依据上表数据列式计算该NaOH溶液的物质的量浓度为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com