
【题目】向三份0.1 ![]()
![]() , 溶液中分别加入少量
, 溶液中分别加入少量![]() 、
、![]() 、
、![]() 固体(忽略溶液体积变化),则
固体(忽略溶液体积变化),则![]() 浓度的变化依次为( )。
浓度的变化依次为( )。
A. 减小、增大、减小 B. 增大、减小、减小
C. 减小、增大、增大 D. 增大、减小、增大
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】已知某有机物的分子式是C6H8O4,关于该分子的结构推测合理的是
A. 可能含有1个苯环
B. 可能含有两个碳碳三键和4个羟基
C. 可能含有2个羧基和1个碳碳双键
D. 可能含有1个醛基、1个羧基、1个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知M、N是合成某功能高分子材料的中间产物,下列关于M、N说法正确的是( )
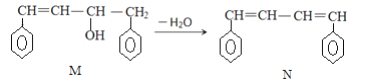
A. M、N都属于烯烃,但既不是同系物,也不是同分异构体
B. M、N分别与液溴混合,均发生取代反应
C. M、N分子均不可能所有原子共平面
D. M、N均可发生加聚反应生成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素A、B、C、D和E的原子序数依次增大。A、B、C、D四种元素核电荷数均小于20,A、B同主族;B、C、D元素的基态原子具有相同的能层数,它们的基态原子中p能级上未成对电子数分别为1、3、1;E是周期表中(除放射性元素外)第一电离能最小的元素。回答下列问题:
(1)写出下列元素的符号:A 、E 。
(2)C元素的价电子排布图为: ;
该排布遵循的原理主要有: (答完整得分)。
(3)C、D元素形成的化合物主要有: (填化学式,答完整得分);其中相对分子质量较小的分子为 分子(填“极性”或“非极性”),该分子的空间构型为 ,中心原子的杂化方式是 。
(4)化合物BD3的熔点190℃、沸点182.7℃,那么BD3的晶体类型为 ;事实上,在BD3的化合物中往往以B2D6的形式存在,该形式的存在是由于 形成的。(选填“氢键”、“范德华力”、“离子键”、“配位键”)
(5)下图为几种晶胞(或晶胞的1/8)示意图,其中![]() 和
和![]() 代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。
代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。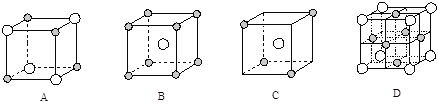
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内液面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中液面继续上升,经过多次重复后,试管内完全充满液体,原来试管中盛装的气体是( )
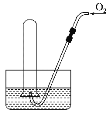
A.可能是N2和NO2的混合气体
B.一定是NO2气体
C.可能是NO与NO2的混合气体
D.只可能是NO2一种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关盐类水解的说法中,不正确的是( )。
A. 盐类的水解过程破坏了纯水的电离平衡
B. 盐类的水解是酸碱中和反应的逆反应
C. 盐类水解后的溶液不一定显中性
D. ![]() 溶液中,
溶液中, ![]() 是
是![]() 的两倍
的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
利用丙炔和苯甲醛研究碘代化合物与苯甲醛在 Cr-Ni 催化下可以发生偶联反应和合成 重要的高分子化合物Y的路线如下:

已知:①R1CHO+R2CH2CHO![]()
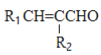 +H2
+H2
②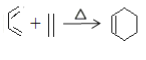
回答下列问题:
(1)A的化学名称为____。
(2)B中含氧官能团的名称是______。
(3)X的分子式为_______。
(4)反应①的反应类型是________。
(5)反应②的化学方程式是_______。
(6)L是D的同分异构体,属于芳香族化合物,与D具有相同官能团,其核磁共振氢谱为5组峰,峰面积比为3:2:2:2:1,则L的结构简式可能为_____。
(7)多环化合物是有机研究的重要方向,请设计由![]() 、CH3CHO、
、CH3CHO、![]() 合成多环化合物
合成多环化合物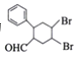 的路线(无机试剂任选)______。
的路线(无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将5.6g铁和4.6g钠分别与100m L 1mol/L的盐酸反应 ,则放出H2的体积( )
A. 铁的多 B. 钠的多 C. 铁和钠放出一样多 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中氨态氮以NH3H2O、NH3和NH4+的形式存在,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点。
Ⅰ.沉淀法
向废水中投入MgCl2和Na2HPO4,生成MgNH4PO46H2O沉淀,可将氨态氮含量降至10mg·L1以下。
(1)NH3的电子式:______。
(2)废水中的NH3H2O转化为MgNH4PO46H2O的离子方程式是______。

(3)16℃时,向废水中加入MgCl2和Na2HPO4,使镁、氮、磷物质的量之比为1︰1︰1,沉淀过程中的pH对剩余氨态氮浓度的影响如图。欲使剩余氨态氮浓度低于10mg·L1,pH的适宜范围是______,pH偏大或者偏小均不利于MgNH4PO46H2O的生成,原因是______。
Ⅱ.微波—氧化法
(4)仅对废水进行微波加热,pH对氨态氮脱出的影响如下表。
溶液pH | 6~7 | 8~9 | 10~11 | 11~12 |
剩余氨态氮浓度(mg·L1) | 156 | 100 | 40 | 14 |
表中数据表明:pH增大有利于废水中化学平衡______(用化学用语表示)的移动。
(5)微波协同CuO和H2O2除去氨态氮
①其他条件相同,取相同体积的同一废水样品,微波10min,剩余氨态氮浓度与一定浓度H2O2溶液添加量的关系如下图。据图推测CuO在氨态氮脱除中可能起催化作用,理由是______。

②微波协同CuO有利于H2O2除去氨态氮。该条件下,H2O2将NH3氧化为N2的化学方程式是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com