
【题目】小明同学在化学兴趣小组中提出一个猜想:“根据学习过的化学反应CaCO3+CO2+H2O=Ca(HCO3)2可以知道,Na2CO3溶液也能与CO2发生反应”.
为了确定小明同学猜想是否正确,兴趣小组在老师的指导下,通过实验探究的方法.完成了对该猜想的判断。请你完成兴趣小组在实验探究活动中的都分实验报告。
【实验目的】:探究Na2CO3溶液与CO2的反应
【实验药品】:Na2CO3溶液,、饱和的Na2HCO3溶液、大理石、CaCl2、CaO、稀盐酸、稀硫酸、浓硫酸、澄清石灰水
【查阅资料】:NaHCO3 与Ca(OH)2发生反应:2NaHCO3 + Ca(OH)2=CaCO3↓+Na2CO3+ 2H2O碳酸氢钠与氯化钙溶液反应生成碳酸钙沉淀、氯化钠、水和二氧化碳.
【实验装置】:
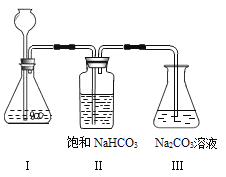
【实验操作步骤与现象】
①写出实验室制取二氧化碳的化学方程式_________________________。
②将制取的CO2 通过饱和的NaHCO3溶液洗气瓶的目的是______________________。
③使过量的CO2 通过装置Ⅲ,充分反应后,将其中所得的溶液取出3mL于试管中,然后向试管中加入___________试剂(请从以上给出的药品中选择)当试管中出现____________现象时,Na2 CO3 溶液与CO2 发生了化学反应,其反应的化学方程式为_____________________。
【结论】:通过实验探究,小明同学的猜想是正确的。
【应用】:你能否依据此化学反应的规律,再写出一个类似的化学反应方程式(写上述已有的两个反应不得分):___________________________。
【答案】(1)CaCO3+2HCl=CaCl2+CO2↑+H2O
(2)除去CO2中混有的HCl气体
(3)CaCl2;气体
Na2CO3+CO2+H2O=2NaHCO3
[应用]:Na2SO3+SO2+H2O=2NaHSO3
【解析】
试题分析:【实验操作步骤与现象】①实验室制取二氧化碳的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑,故填:CaCO3+2HCl═CaCl2+H2O+CO2↑.
②盐酸易挥发,将制取的CO2通过饱和的NaHCO3溶液洗气瓶的目的是除去混入的氯化氢气体,故填:除去混入的氯化氢气体.
③使过量的CO2通过装置Ⅲ,充分反应后,将其中所得的溶液取出3mL于试管中,然后向试管中加入氯化钙,当试管中产生沉淀、气泡时,说明溶液中含有碳酸氢钠,进一步说明Na2CO3溶液与CO2发生了化学反应生成碳酸氢钠,其反应的化学方程式为:Na2CO3+CO2+H2O=2NaHCO3,故填:氯化钙;产生沉淀、气泡;Na2CO3+CO2+H2O=2NaHCO3.
【应用】碳酸钾能和水、二氧化碳反应生成碳酸氢钾,反应的化学方程式为:K2CO3+CO2+H2O=2KHCO3,故填:K2CO3+CO2+H2O=2KHCO3。


科目:高中化学 来源: 题型:
【题目】标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是

A. b点水的电离程度比c点水的电离程度大
B.氢硫酸的酸性比亚硫酸的酸性强
C.原H2S溶液的物质的量浓度为0.05 mol·L-1
D.a点对应溶液的导电性比d点强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、镁、铝各0.3 mol,分别放入100 mL 1 mol·L—1的硫酸中,同温同压下产生的气体的体积比是
A. 1∶2∶3 B. 6∶3∶2 C. 3∶2∶2 D. 3∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用分液的方法可以分离汽油和水 B. 酒精灯加热试管时须垫石棉网
C. NH3能使湿润的蓝色石蕊试纸变红 D. 盛放NaOH溶液的广口瓶,可用玻璃塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某学生设计如下实验方案:

(1)操作①为_____________________;
(2)操作②③④加入的试剂依次可以为:___________、____________、____________。
(3)如何判断SO42-已除尽,简述实验操作_________________________。
(4)实验过程中产生的多次沉淀__________(填“需要”或“不需要”)多次过滤,理由是_______________。
(5)该同学的实验设计方案___________(填“合理”或“不合理”),理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组讨论辨析下列说法,其中正确说法的数目为
①碱性氧化物都是金属氧化物,酸酐都是氧化物
②AlCl3溶液和Al(OH)3胶体的本质区别在于是否有丁达尔效应
③若规定0.024kg12C含有的原子数为阿伏加德罗常数,则标准状况下44gCO2的体积约为44.8L
④标准状况下,气体体积的大小取决于粒子数目和粒子间的平均距离
⑤同温同压下,等质量的二氧化硫气体和二氧化碳气体密度比为16:11,体积比为11:16
⑥把0.05mol氢氧化钡固体加入到100ml 1.0vmol/L盐酸中,溶液导电性基本不变
⑦活泼金属钾、钙、钠、镁、铝均由电解对应的熔融氧化物制得
⑧合金熔点、硬度都低于成分金属,青铜是使用最早的合金,钢是用量最大用途最广的合金
⑨同素异形体:C60、12C、金刚石、石墨
⑩工业合成氨是人工固氮的主要方法,工业生产玻璃、水泥、冶炼铁都需要用到的原料是石灰石
A.3 B.5 C.4 D .7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72LCH4;②3.01X1023个HCl;③13.6gH2S;④0.2molNH3.下列对四种气体的关系从小到大表示不正确的是
A.体积:④<①<②<③ B.密度:①<④<③<②
C.质量:④<①<③<② D.氢原子数:②<④<③<①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com