
【题目】一定温度下,在固定体积的密闭容器中发生下列反应:2HI![]() H2+I2。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为 ( )
H2+I2。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为 ( )
A. 5 sB. 10 sC. 大于10 sD. 小于10 s
科目:高中化学 来源: 题型:
【题目】完成下列化学用语:
(1)CH4和Cl2反应生成一氯甲烷的化学方程式: _________。反应类型是_________。
(2)乙烯使Br2/CCl4溶液褪色所发生反应方程式_________。反应类型是_________。
(3)乙醇与氧气反应生成乙醛的化学方程式_________。反应类型是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关,下列有关说法正确的是
A. 刚玉(Al2O3)硬度仅次于金刚石,熔点也相当高,刚玉坩埚可用于熔融碳酸钾
B. “火树银花”的烟花场景利用的是金属的颜色反应
C. 石油分馏可得到乙烯、丙烯、丁二烯等短链烃
D. 盐析可提纯蛋白质,并保持其生理活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是( )
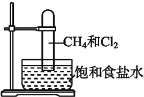
A. 此反应无光照也可发生
B. 盛放饱和食盐水的水槽底部会有少量晶体析出
C. 甲烷和Cl2反应后的产物只有CH3Cl和HCl
D. CH4和Cl2完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物在材料领域中的应用广泛.下列叙述不正确的是( )
A. 硅单质可用来制造太阳能电池
B. 二氧化硅是制造光导纤维的材料
C. 石英(SiO2)可用来制作工艺品
D. 硅单质是制造玻璃的主要原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瓷器(英文名为________)成了中华民族文化的象征之一;作为陶瓷的故乡,我国陶都________的陶器和瓷都________的瓷器,在世界上都享有盛誉.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
①化石燃料在任何条件下都能充分燃烧
②化石燃料在燃烧过程中能产生污染环境的CO、SO2 等有害气体
③直接燃烧煤不如将煤进行深加工后再燃烧效果好
④固体煤变为气体燃料后,燃烧效率将更低
A.①④B.②③④C.②③D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍等金属单质及化合物有广泛的应用。
(1)已知锂离子电池总反应方程式是FePO4(s)+Li(s) ![]() LiFePO4(s)。请写出Fe3+的电子排布式____________,PO43-离子中p原子杂化轨道类型____________。
LiFePO4(s)。请写出Fe3+的电子排布式____________,PO43-离子中p原子杂化轨道类型____________。
(2)化合物“钴酞菁”能显著提升二次电池的充放电效率,下图是改性“氨基钴酞菁”分子的结构图。
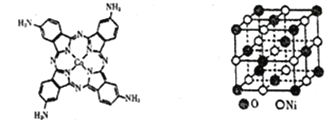
①一个电子的运动状态取决于______种因素,基态Co原子中空间运动状态不同的电子数为___种。
②氨基钴酞菁中非金属元素的电负性从大到小的顺序为_________
③“氨基钴酞菁”比“钴酞菁”显著溶于水,请简述其原因_______。
(3)K3[Co(NO2)6]中存在的化学键类型有____________,配位数为_______。
(4)Sr和Ca为同族金属元素,CaO与SrO熔点更高、硬度更大,请简述原因______。
(5)如上图所示为NiO晶体的晶胞示意图:
①该晶胞中与一个Ni最近等距离的O构成的空间几何形状为____________________。
②在NiO晶体中Ni2+的半径为apm,O3-的半径为bpm,假设它们在晶体中是紧密接触的,则其密度为___g/cm3。(用含字母a、b的计算式表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜阳极泥是有色金属冶炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下:
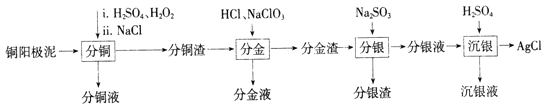
已知:分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl和PbSO4;分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-。
Ag++2SO32-。
(1)①“分铜”时,单质铜发生反应的化学方程式为________;反应过程中需控制适当温度,温度不宜过高或过低的原因为_______。
②已知“分铜”时 各元素的浸出率如下表所示。
Cu | Au | Ag | |
浸出率/% | 85.7 | 0 | 4.5 |
“分铜”时加入足量的NaCl的主要作用为__________
(2)“分金”时,单质金发生反应的离子方程式为___________。
(3)“沉银”时,需加入硫酸调节溶液的pH=4。已知: ![]() ,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
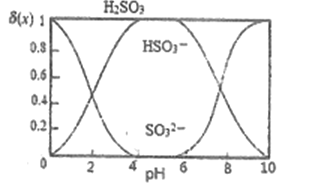
①分析能够析出AgCl的原因为_________
②调节溶液的PH不能过低,理由为__________
(4)“沉银液”加碱调至pH=8.0,Na2SO3可再生并循环利用,其再生原理为____(用离子方程式表示)。
(5)已知离子浓度≤10-5mol/L时,认为该离子沉淀完全;Ksp[Pb(OH)2]=2.5×10-16.
Ksp[Sb(OH)3])=10-41. 浸取“分银渣”可得到含0.025mol/L Pb2+的溶液( 含少量Sb3+杂质)。欲获得较纯净的Pb2+溶液,调节PH的范围为________。 (忽略溶液体积变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com