
【题目】瘦肉精,学名盐酸克伦特罗,该药物既不是兽药,也不是饲料添加剂,而是肾上腺类神经兴奋剂,可以增加动物的瘦肉量.减少饲料使用.使肉品提早上市,降低成本,但对人体会产生副作用,盐酸克伦特罗分子结构简式如下图。下列说法不正确的是( )

A.瘦肉精的分子式是C11H18ON2Cl2
B.物质能发生取代反应、氧化反应、加成反应和水解反应
C.1mol盐酸克伦特罗最多能与4molNaOH反应
D.盐酸克伦特罗分子中至少有7个碳原子共面
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
①二氧化硅可与NaOH溶液反应,因此可用NaOH溶液雕刻玻璃;
② 明矾溶于水可水解生成Al(OH)3胶体,因此可以用明矾对自来水进行杀菌消毒;
③ 可用蒸馏法、电渗析法、离子交换法等对海水进行淡化;
④ 从海带中提取碘只需用到蒸馏水、H2O2溶液和四氯化碳三种试剂;
⑤地沟油可用来制肥皂、提取甘油或者生产生物柴油;
⑥石英玻璃、Na2O·CaO·6SiO2、淀粉、氨水的物质类别依次为纯净物、氧化物、混合物、弱电解质。
A. ③⑤⑥ B. ①④⑤ C. 除②外都正确 D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学探究 Cu 与 NO 的反应,查阅资料:①Cu 与 NO 反应可生成 CuO 和 N2,②酸性条件下,NO 或 NO2–都能与 MnO4–反应生成 NO3–和 Mn2+
(1)实验室利用Cu和稀 HNO3 制备 NO,写出反应的化学方程式____。
(2)选用如图所示装置完成Cu与NO的实验。(夹持装置略) 实验开始前,向装置中通入一段时间的N2。回答下列问题:
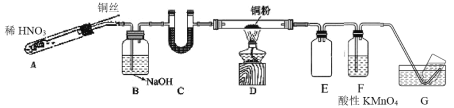
①使用铜丝的优点是____装置 E 的作用为____。
②装置 C 中盛放的药品可能是____;
③装置 D 中的现象是____;装置 F 中反应的离子方程式是____。
(3)测定NaNO2 和 NaNO3混合溶液中NaNO2的浓度。取 25.00mL混合溶液于锥形瓶中,用0.1000mol·L-1 酸性 KMnO4 溶液进行滴定,实验所得数据如表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗 KMnO4 溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是____(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.因为没有一直观察锥形瓶中溶液颜色变化,判断滴定终点时溶液已变红d.酸性 KMnO4 溶液中含有其他氧化性试剂e.锥形瓶洗净后用待测液润洗
②酸性 KMnO4溶液滴定亚硝酸钠溶液的离子方程式为____。
③NaNO2的物质的量浓度为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
提出猜想:
问题1:在元素周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性弱于的Fe3+,Cu+的稳定性也弱于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
实验探究:
Ⅰ.解决问题1:
(1)实验需配制100mL0.50molL-1CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、___、___。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②___。
Ⅱ.解决问题2的实验和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象回答下列问题:
(3)写出氧化亚铜与稀硫酸反应的离子方程式:___。
(4)从实验中可得出的结论:当温度在1000℃以上时___(填Cu2+或Cu+,下同)稳定,在酸性溶液中___稳定。
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是___。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确(只需要写出一种方法即可)。___
实验步骤 | 实验结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表中短周期的一部分,下列关于Y、Z、M的说法正确的是 ( )

A.电负性:![]()
B.离子半径:![]()
C.![]() 分子中各原子的最外层均满足8电子稳定结构
分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子的最外层电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.1 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌;③________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为____________________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和________。
(4)“氧化”生成Ni2O3的离子方程式为__________________________________。
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则①NH4Cl的浓度最好控制为__________________________。
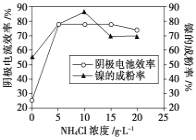
②当NH4Cl的浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:________________________。
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 为五种短周期元素。
为五种短周期元素。![]() 原子的质子数与电子层数相同,
原子的质子数与电子层数相同,![]() 原子核外电子数是
原子核外电子数是![]() 原子最外层电子数的2倍,
原子最外层电子数的2倍,![]() 、
、![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。下列说法不正确的是( )
在周期表中的相对位置如图所示。下列说法不正确的是( )
|
|
| |
|
A.原子半径:![]()
B.热稳定性:![]() ;沸点:
;沸点:![]()
C.仅由![]() 、
、![]() 、
、![]() 三种元素形成的化合物中不可能含离子键
三种元素形成的化合物中不可能含离子键
D.![]() 、
、![]() 分子中每个原子最外层均满足8电子结构
分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象中正确的是( )

A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种具有抗痢疾的某种药物的中间体,其合成路线如图:
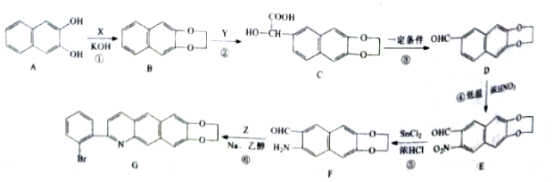
已知:![]() +R3NH2
+R3NH2![]() +H2O
+H2O
(1)X的分子式为C2H4Cl2,写出其化学名称____。
(2)①的反应类型为____。
(3)D中官能团的名称为____。
(4)E的分子式为____。
(5)芳香族化合物Z的分子式为C8H7OBr,写出Z的结构简式____。
(6)同时满足下列条件的D的同分异构体有多种,写出任意一种的结构简式____。
①能与氯化铁发生显色反应
②能与纯碱反应放出二氧化碳气体
③除苯环外无其他环状结构
④核磁共振氢谱为四组峰,峰面积比为1:1:2:6
(7)写出![]() 和
和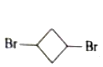 为有机原料制备
为有机原料制备![]() 的流程图。____
的流程图。____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com