
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀盐酸 | 锌粒 | H2 | NaOH溶液 |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积,设计的简易实验装置如图.该实验的主要操作步骤如下:
(1)请将下列步骤补充完整并回答下列问题:①配制浓度均为1mol/L的盐酸和醋酸溶液;
②用量取10.00mL 1mol/L的盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应 , 读出量筒中水的体积为V mL.
(2)用文字表述④检查该装置气密性的操作与观察方法: .
(3)本实验中应选用(填序号)的量筒.
A.100mL
B.200mL
C.500mL
(4)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为Vm= .
(5)速率不等的原因是 , 铜丝不与酸接触的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积固定的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)
CO(g)
+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注.
(1)As的原子结构示意图为 ![]() ,则其在周期表中的位置是 .
,则其在周期表中的位置是 .
(2)N元素非金属性比As强,下列说法正确的是 . ①NH3的热稳定性比AsH3差
②HNO3的酸性比H3AsO4强
③N的原子半径比As的原子半径小
(3)根据如图写出As2O5分解为As2O3的热化学方程式 . 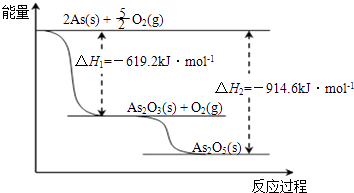
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3 , 提取的工艺流程简图如下: 
①As2S3、Na3AsS3中的S均为﹣2价,碱浸过程中发生的反应(填“是”或“不是”)氧化还原反应.
②过程Ⅲ的系列操作包括 .
③写出过程Ⅲ的离子方程式 ,
过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25℃时pH=12的NaOH溶液100mL.,欲用以下几种方法将其pH调整到11,回答下列问题(已知混合后溶液的总体积等于混合前两稀溶液的体积之和):
(1)25℃时,pH=12的NaOH溶液中由水电离产生的c(OH﹣)=
(2)加水稀释,需加水的体积为mL.
(3)加入pH=2的盐酸,需加盐酸的体积为mL.(精确到0.1)
(4)加入pH=10的NaOH溶液,需加NaOH溶液的体积为mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究锌与盐酸反应过程的速率变化以及影响反应快慢的因素,在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表所示(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)反应速率最大的时间段(指0~1、1~2、2~3、3~4、4~5 min)是_______________min,该时间段以盐酸的浓度变化表示的该反应的速率是______________________。从影响反应速率的外界条件分析原因是_______________________________________。
(2) 反应速率最小的时间段(指0~1、1~2、2~3、3~4、4~5 min)是_____________min,原因是_______________________________________________。
(3)如果反应过于剧烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液,你认为可行的是________(填序母)。
A.蒸馏水 B.NaCl溶液 C.NaNO3溶液 D.CuSO4溶液 E.Na2CO3溶液,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为反应:H2(g)+Cl2(g)=2HCl(g)的能量变化示意图,下列说法正确的是( ) 
A.该反应的反应热△H=﹣183kJmol﹣1
B.该反应生成液态HCl比生成气态HCl释放的能量少
C.氯气分子中的化学键比氢气分子中的化学键更稳定
D.1 mol HCl分子中的化学键形成时吸收431kJ的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com