
【题目】某种制取纯碱的生产流程如下图所示:
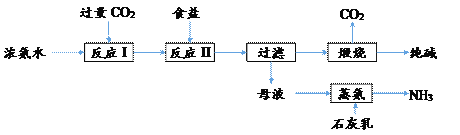
完成下列填空:
(1)N原子核外有_______种不同运动状态的电子,它的最外层电子排布式是________;组成纯碱的元素原子半径从大到小依次为___________________。
(2)氨水是常用氮肥,用氨水施肥时要避开高温、大风天气,原因是_______________。
(3)用离子方程式表示碳酸钠被称为“碱”的原因_____________________________ 。
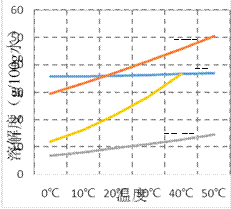
(4)结合下图用溶解平衡理论解释反应II的反应原理____________________________________。
(5)在向母液中通入石灰乳进行蒸氨之前,通常需要先将母液加热。若不加热,加入石灰乳容易产生沉淀堵塞管道,生成的沉淀是________。
(6)上述流程中可以循环利用的物质有________,副产物是______________。
(7)利用化工生产遵循的一般原则分析上述纯碱生产流程,指出不足之处____________________(写一条)。
【答案】7 2s22p3 Na > C >O 氨水易挥发,大风高温天气加速氨气挥发从而失去肥效 CO32- + H2O ![]() HCO3- + OH- 碳酸氢钠溶解度最小;反应I生成高浓度HCO3-,反应II加入大量Na+,造成溶液中HCO3-和Na+的离子浓度超出碳酸氢钠饱和溶液浓度,所以析出碳酸氢钠 CaCO3 CO2,NH3 CaCl2 有副产物生成,原料没有充分利用(或母液中有大量氯化钠与氯化钙一起排出,原料没有充分利用。)
HCO3- + OH- 碳酸氢钠溶解度最小;反应I生成高浓度HCO3-,反应II加入大量Na+,造成溶液中HCO3-和Na+的离子浓度超出碳酸氢钠饱和溶液浓度,所以析出碳酸氢钠 CaCO3 CO2,NH3 CaCl2 有副产物生成,原料没有充分利用(或母液中有大量氯化钠与氯化钙一起排出,原料没有充分利用。)
【解析】
(1)N原子核电荷数为7,核外有7个电子,每一个电子的运动状态都不相同,所以氮原子核外有7种不同运动状态的电子,它的最外层电子排布式是2s22p3;纯碱所含元素分别为:钠、碳、氧,电子层数越多,原子半径越大,同一周期,从左到右,原子半径减小,因此钠、碳、氧三种元素原子半径从大到小依次为Na > C >O;正确答案:7;2s22p3;Na > C >O。
(2)氨水是常用氮肥,用氨水施肥时要避开高温、大风天气,原因是氨水易挥发,大风高温天气加速氨气挥发从而失去肥效;正确答案:氨水易挥发,大风高温天气加速氨气挥发从而失去肥效。
(3)碳酸钠在水中发生水解,生成碳酸氢钠和氢氧化钠,离子方程式为CO32- + H2O ![]() HCO3- + OH- ;正确答案: CO32- + H2O
HCO3- + OH- ;正确答案: CO32- + H2O ![]() HCO3- + OH- 。
HCO3- + OH- 。
(4)根据图示,碳酸氢钠溶解度最小;反应I生成高浓度HCO3-,反应II加入大量Na+,造成溶液中HCO3-和Na+的离子浓度超出碳酸氢钠饱和溶液浓度,所以析出碳酸氢钠;正确答案:碳酸氢钠溶解度最小;反应I生成高浓度HCO3-,反应II加入大量Na+,造成溶液中HCO3-和Na+的离子浓度超出碳酸氢钠饱和溶液浓度,所以析出碳酸氢钠。
(5)母液中含有氯化铵和极少量的碳酸氢钠, 碳酸氢钠溶液与石灰乳反应生成碳酸钙沉淀,易堵塞管道,正确答案:CaCO3。
(6)上述流程中,氨气、二氧化碳既是反应物,也是生成物,因此在整个流程中可以循环利用;整个反应中氢氧化钙与氯化铵反应生成了氨气和氯化钙副产物;正确答案:CO2,NH3 ;CaCl2。
(7)利用化工生产遵循的一般原则分析上述纯碱生产流程,其不足之处是有副产物生成,原料没有充分利用(或母液中有大量氯化钠与氯化钙一起排出,原料没有充分利用);正确答案:有副产物生成,原料没有充分利用(或母液中有大量氯化钠与氯化钙一起排出,原料没有充分利用)。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液,pH变化如右图所示,下列有关叙述正确的是( )
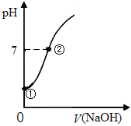
A. ①点所示溶液中只存在HClO的电离平衡
B. ①到②水的电离程度逐渐减小
C. I-能在②点所示溶液中存在
D. ②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。2R-C≡C-H![]() R-C≡C-C≡C-R+H2, 该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
R-C≡C-C≡C-R+H2, 该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为________,D的化学名称为________。
(2)①和③的反应类型分别为________、________。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气__ mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为__________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为__________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3∶1,写出其中3种的结构简式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是

A. 电流由O2所在的铂电极经外电路流向另一电极
B. O2所在的铂电极处发生还原反应
C. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-="=" 2CO2↑+12H+
D. 微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置可间接氧化工业废水中含氮离子(NH4+)。下列说法不正确的是
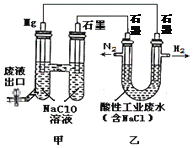
A. 乙是电能转变为化学能的装置
B. 含氮离子氧化时的离子方程式为:3Cl2 + 2NH4+=N2 + 6Cl-+8H+
C. 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH减小
D. 电池工作时,甲池中的Na+移向Mg电极
【答案】D
【解析】A、甲中活泼金属镁作原电池的负极,石墨为正极形成原电池,乙是连接原电池的电解池,电解酸性工业废水,电解池是将电能转变为化学能的装置,选项A正确;B、酸性条件下含氮离子氧化时转化为氮气,反应的离子方程式为:3Cl2 + 2NH4+=N2 + 6Cl-+8H+,选项B正确;C、若生成H2和N2的物质的量之比为3:1,根据电极反应6H++6e-=3H2↑、3Cl2 + 2NH4+=N2 + 6Cl-+8H+,则处理后废水的H+浓度增大,pH减小,选项C正确;D、电池工作时,甲池是原电池,原电池中阳离子Na+移向正极石墨电极,选项D不正确。答案选D。
【题型】单选题
【结束】
7
【题目】已知某透明澄清的溶液中可能含有NO3- 、Cl- 、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,同时产生红褐色沉淀; ②将沉淀过滤、洗涤、灼烧,得到1.6 g固体; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。下列说法正确的是
A. 不能确定原溶液中是否含有Al3+和K+
B. 原溶液中含有的离子只有:Cl- 、SO42-、NH4+、Fe3+
C. 原溶液中c(NO3-)=0.2 mol·L-1 c(Fe3+)=0.2 mol·L-1
D. 在原溶液中加入足量的铁粉所得溶液中阳离子所带正电荷数减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊在元素周期表中的相对位置如图所示。下列说法正确的是
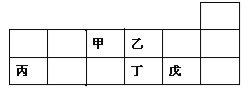
A. 原子半径的大小顺序为:甲>乙>丙>戊
B. 氢化物的稳定性:乙>丁;氢化物的沸点:丁>乙
C. 元素甲与元素丙的最高正化合价之和的数值等于8
D. 元素戊的氧化物对应的水化物的酸性一定比丁的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2mol·L-1,0.2 mol·L-1,0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2mol·L-1,0.2 mol·L-1,0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
A. c(SO3)=0.4 mol·L-1B. c(SO2)=c(SO3)=0.15 mol·L-1
C. c(O2)=0.1 mol·L-1D. c(SO2)+c(SO3)=0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2===CH2(g)+H2O(g) ![]() CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是:
CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是:
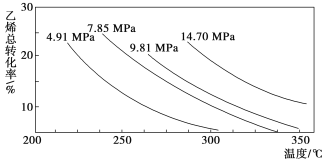
A. 合成乙醇的反应一定为吸热反应
B. 目前工业上采用250~300 ℃,主要是因为在此温度下乙烯的转化率最大
C. 目前工业上采用加压条件(7 MPa左右),目的是提高乙醇的产率和加快反应速率
D. 相同催化剂下,在300 ℃ 14.70 MPa乙醇产率反而比300 ℃ 7.85 MPa低得多,是因为加压平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com