
【题目】![]() 时,向
时,向![]() 中不断滴入
中不断滴入![]() ,混合溶液pH变化如图所示。此过程溶液下列说法不正确的是
,混合溶液pH变化如图所示。此过程溶液下列说法不正确的是![]() 已知:
已知:![]() 时一元酸
时一元酸![]() 电离平衡常数
电离平衡常数![]()
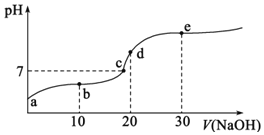
A.a点溶液的pH大于3
B.b点溶液中离子:![]()
C.c点表示酸![]() 和
和![]() 溶液恰好完全反应
溶液恰好完全反应
D.d点溶液加水稀释后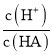 的值会增大
的值会增大
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是

A. A、B之间任意一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为电解饱和食盐水装置,下列有关说法不正确的是

A. 左侧电极上发生氧化反应
B. 右侧生成的气体能使湿润的淀粉碘化钾试纸变蓝
C. 电解一段时间后,B口排出NaOH溶液
D. 电解饱和食盐水的离子方程式: 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯是重要的化工原料。其实验室制备流程如下:
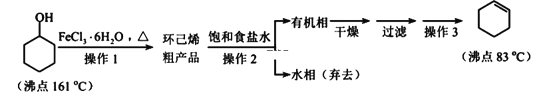
回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为____________,现象为__________________。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
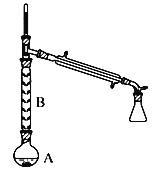
①烧瓶A中进行的可逆反应化学方程式为___________________,浓硫酸也可作该反应的催化剂,选择FeCl36H2O而不用浓硫酸的原因为________________(填序号)。
a.浓硫酸易使原料炭化并产生SO2
b. FeCl36H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl36H2O比浓硫酸的平衡转化率高
②仪器B的作用为____________。
(3)操作2用到的玻璃仪器是____________。
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,____________,弃去前馏分,收集83℃的馏分。
Ⅱ.环己烯含量的测定
在一定条件下,向ag环己烯样品中加入定量制得的bmolBr2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用cmolL-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液vml (以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①Br2+![]() →
→![]()
②![]()
③![]()
(5)样品中环己烯的质量分数为___________(用字母表示)。
(6)下列情况会导致测定结果偏低的是____________(填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c. Na2S2O3标准溶液部分被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,1 mol浓硝酸与足量Al反应,转移电子数为3NA
B.标准状况下,5.6 L Cl2完全溶解于水配成1 L溶液,溶液中Cl-数为0.5NA
C.20 gH218O含有的中子数为10NA
D.1 L 0.5 mol·L-1 Al2(SO4)3溶液中阳离子所带电荷数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJmol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJmol-1
③H2O(g)=H2O(l) △H=-44 kJmol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l) 的热化学方程式_________。
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+ O3(g) NO2(g)+O2(g) △H1= -200.9 kJmol-1Ea1= 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g) SO3(g)+O2(g)△H2= -241.6 kJmol-1 Ea2= 58 kJmol-1
已知该体系中臭氧发生分解反应:2O3(g) 3O2(g)。请回答:
其它条件不变,每次向容积为2L的反应器中充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
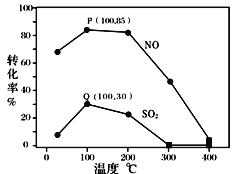
①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是 ____________ 。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
③假设100℃时P(NO转化率为85%)、Q(SO2转化率为30%)均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是_______mol;NO的平均反应速率为_______________;反应Ⅱ在此时的平衡常数为_______________ 。
(3)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
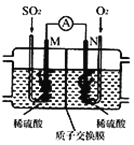
①M极发生的电极反应式为 ____________。
②当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量_____(填“增大”或“减小”)_______克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol·L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是
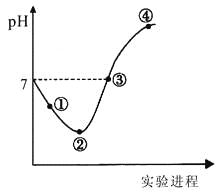
A.曲线起点处水的电离程度最大,可用pH试纸测定溶液pH
B.②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO-
C.氯气~氯水体系中:c(H+)=c(Cl2) +c(HClO)+c(ClO-)
D.③点所示溶液中:c(Na+) = c(Cl-)+c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,用浓度为
时,用浓度为![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 相同浓度的HX溶液,滴定曲线如图所示。下列说法正确的是
相同浓度的HX溶液,滴定曲线如图所示。下列说法正确的是![]()
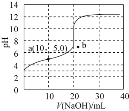
A.达到滴定终点时,溶液的![]()
B.根据图象可估算出![]() 的值约为
的值约为![]()
C.a点所得溶液中:![]()
D.若用相同浓度的氨水替代NaOH溶液,滴定终点移向b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)有一种多氯代甲烷为常用有机溶剂,其分子结构为正四面体,它是______(写化学式)
(2)聚四氟乙烯稳定、无毒,是不粘锅的涂层,它的结构简式是________________
(3)已知乙二酸俗名草酸,在工业上有广泛的用途,根据下列合成路线填空:

分别写出反应②③的化学反应方程式:________;_____________。
(4)按要求完成下列问题:在 ①苯 ②乙醇 ③甲苯 ④氯乙烷 ⑤![]() ⑥
⑥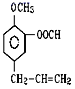 ⑦
⑦![]() 七种物质中(填编号):
七种物质中(填编号):
①能和金属钠反应放出H2的有________;
②常温下能与溴水化学反应的有________;
③能使酸性KMnO4溶液褪色的有________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com