
【题目】![]() 时,用浓度为
时,用浓度为![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 相同浓度的HX溶液,滴定曲线如图所示。下列说法正确的是
相同浓度的HX溶液,滴定曲线如图所示。下列说法正确的是![]()
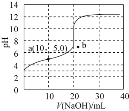
A.达到滴定终点时,溶液的![]()
B.根据图象可估算出![]() 的值约为
的值约为![]()
C.a点所得溶液中:![]()
D.若用相同浓度的氨水替代NaOH溶液,滴定终点移向b点
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】请结合下列有机物回答相关问题,
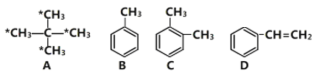
(1)应用系统命名法对有机物A进行命名:___________,标注“*”的碳原子连接起来构成的图形为________(填“菱形”、“正方形”或“正四面体形”)。E是A的同系物,且比A少一个碳原子,则E的一氯代物有______种。
(2)相同质量的上述四种有机物完全燃烧时耗氧量最小的是_____________(填名称)。
(3)有机物B能实现如下转化:
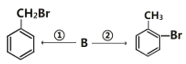
各步转化的反应方程式为①___________________________;②___________________________。
(4)D在一定条件下生成高分子化合物的反应化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,向
时,向![]() 中不断滴入
中不断滴入![]() ,混合溶液pH变化如图所示。此过程溶液下列说法不正确的是
,混合溶液pH变化如图所示。此过程溶液下列说法不正确的是![]() 已知:
已知:![]() 时一元酸
时一元酸![]() 电离平衡常数
电离平衡常数![]()
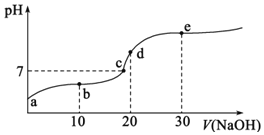
A.a点溶液的pH大于3
B.b点溶液中离子:![]()
C.c点表示酸![]() 和
和![]() 溶液恰好完全反应
溶液恰好完全反应
D.d点溶液加水稀释后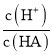 的值会增大
的值会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系式中,正确的是
A. 等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO- )+c(OH-)=c(H+)+c(CH3COOH)
B. 常温下,0.1 mol·L-1HA溶液与0.1 mol·L NaOH溶液等体积完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH )=c(H+)
C. 常温下,0.1 mol·L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
D. 常温下,将0.1 mol·L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中c(CHCOO-)/c(CHCOOH)的值增大到原来的100倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)一定温度下,在容积固定的密闭容器中进行的可逆反应:2NO2![]() 2NO+O2,达到平衡的标志是
2NO+O2,达到平衡的标志是
①相同时间内,氧气的生成速率为n mol·L-1·s-1,NO2的生成速率为2n mol·L-1·s-1
②单位时间内生成n mol O2的同时生成2n mol的NO
③混合气体的颜色不再变化 ④混合气体的密度保持不变
⑤混合气体的平均相对分子质量不再改变 ⑥压强不随时间变化而变化
A. ①③⑤⑥ B. ②③⑤
C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
HF(aq)+OH—(aq)=F—(aq)+H2O(l)△H=—67.7 kJ·mol—1
②H+(aq)+OH—(aq)=H2O(l)△H=—57.3 kJ·mol—1
在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
A. 氢氟酸的电离方程式及热效应可表示为HF(aq)=H+(aq) +F(aq) △H=+10.4kJ·mol—1
B. 当V=20时,溶液中:c(OH—)=c(HF) +c(H+)
C. 当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1
D. 当V>0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。
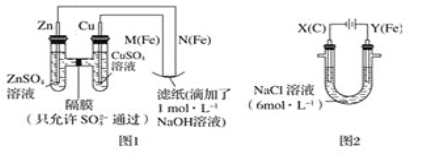
请回答:
Ⅰ.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是___(填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为___。
(3)实验过程中,SO42-___(填“从左向右”,“从右向左”或“不”)移动;滤纸上能观察到的现象有:___。
Ⅱ.用图2所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH___(填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应之一为Fe﹣6e-+8OH-=FeO42-+4H2O,若在X极收集到784mL气体,在Y极收集到112mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少___g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符号: X________、Y__________、Z____________、W、________
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为__________________,______________________。
(3)由X、Y、Z所形成的离子化合物是________________,它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由已知电离常数判断,下列关于SO2与Na2CO3(aq)反应的离子方程式的书写中,不合理的是( )
酸 | 电离常数 |
碳酸 | K1=4×10-7 K2=5.6×10-11 |
亚硫酸 | K1=1.54×10-2 K2=1.02×10-7 |
A.SO2+H2O+2CO32-=2HCO3-+SO32-
B.SO2+H2O+CO32-=H2O+CO2+SO32-
C.2SO2+2H2O+CO32-=H2O+CO2+2HSO3-
D.SO2+H2O+CO32-=HCO3-+HSO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com