
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。
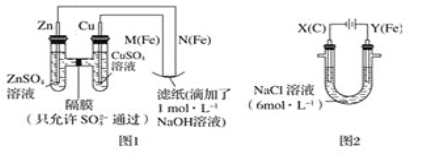
请回答:
Ⅰ.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是___(填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为___。
(3)实验过程中,SO42-___(填“从左向右”,“从右向左”或“不”)移动;滤纸上能观察到的现象有:___。
Ⅱ.用图2所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH___(填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应之一为Fe﹣6e-+8OH-=FeO42-+4H2O,若在X极收集到784mL气体,在Y极收集到112mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少___g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为___。
【答案】A 2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-) 从右向左 滤纸上有红褐色斑点 增大 0.56 2FeO42-+6e-+5H2O=Fe2O3+10OH-
【解析】
Ⅰ.图1中左边为原电池,由于Zn比Cu活泼,则Zn为负极,Cu为正极,M为阳极,N为阴极;
(1)在保证电极反应不变的情况下,仍然是锌作负极,则正极材料必须是不如锌活泼的金属或导电的非金属,铝是比锌活泼的金属,所以不能代替铜,故选 ![]() 。
。
(2)![]() 电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应,电极反应式为:
电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应,电极反应式为:![]() (或
(或![]() )。
)。
(3)原电池放电时,阴离子向负极移动,所以硫酸根从右向左移动,电解池中,阴极上氢离子得电子生成氢气,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化生成氢氧化铁,所以滤纸上有红褐色斑点产生。
Ⅱ.图2中Y(Fe)为阳极,X(C)为阴极;
(4)电解过程中,阴极上氢离子放电生成氢气,则阴极附近氢氧根离子浓度大于氢离子溶液,溶液呈碱性,溶液的 ![]() 增大。
增大。
(5)![]() 电极上析出的是氢气,
电极上析出的是氢气,![]() 电极上析出的是氯气,且
电极上析出的是氯气,且 ![]() 电极失电子进入溶液,设铁质量减少为
电极失电子进入溶液,设铁质量减少为 ![]() ,根据转移电子数相等得
,根据转移电子数相等得 ![]() ,解得
,解得![]() 。
。
(6)正极上高铁酸根离子得电子发生还原反应,电极反应式为 ![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图为电解饱和食盐水装置,下列有关说法不正确的是

A. 左侧电极上发生氧化反应
B. 右侧生成的气体能使湿润的淀粉碘化钾试纸变蓝
C. 电解一段时间后,B口排出NaOH溶液
D. 电解饱和食盐水的离子方程式: 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol·L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是
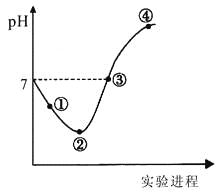
A.曲线起点处水的电离程度最大,可用pH试纸测定溶液pH
B.②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO-
C.氯气~氯水体系中:c(H+)=c(Cl2) +c(HClO)+c(ClO-)
D.③点所示溶液中:c(Na+) = c(Cl-)+c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,用浓度为
时,用浓度为![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 相同浓度的HX溶液,滴定曲线如图所示。下列说法正确的是
相同浓度的HX溶液,滴定曲线如图所示。下列说法正确的是![]()
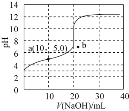
A.达到滴定终点时,溶液的![]()
B.根据图象可估算出![]() 的值约为
的值约为![]()
C.a点所得溶液中:![]()
D.若用相同浓度的氨水替代NaOH溶液,滴定终点移向b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知镓(31Ga)和溴(35Br)是第四周期的主族元素。下列分析错误的是( )
A.镓元素为第四周期第ⅢA元素
B.原子半径:Br>Ga
C.79Br与81Br得电子能力相同
D.碱性:Ga(OH)3>Al(OH)3,酸性:HClO4>HBrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)有一种多氯代甲烷为常用有机溶剂,其分子结构为正四面体,它是______(写化学式)
(2)聚四氟乙烯稳定、无毒,是不粘锅的涂层,它的结构简式是________________
(3)已知乙二酸俗名草酸,在工业上有广泛的用途,根据下列合成路线填空:

分别写出反应②③的化学反应方程式:________;_____________。
(4)按要求完成下列问题:在 ①苯 ②乙醇 ③甲苯 ④氯乙烷 ⑤![]() ⑥
⑥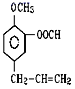 ⑦
⑦![]() 七种物质中(填编号):
七种物质中(填编号):
①能和金属钠反应放出H2的有________;
②常温下能与溴水化学反应的有________;
③能使酸性KMnO4溶液褪色的有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是高熔点金属,工业上用主要成分为FeWO4和MnWO4的黑钨铁矿与纯碱共熔冶炼钨的流程如下,下列说法不正确的是( )
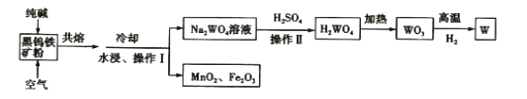
A.将黑钨铁矿粉碎的目的是增大反应的速率
B.共熔过程中空气的作用是氧化Fe(II)和Mn(II)
C.操作II是过滤、洗涤、干燥,H2WO4难溶于水且不稳定
D.在高温下WO3被氧化成W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com