
| A、Fe与S混合加热生成FeS2 |
| B、过量的铜与浓硝酸反应有一氧化氮生成 |
| C、NaHCO3的热稳定性大于Na2CO3 |
| D、白磷在空气中加热到一定温度能转化为红磷 |


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
| 元素 | A | B | D | E |
| 性质 结构 信息 | 单质及其盐的焰色反应为紫色(透过蓝色钻玻璃观察) | 工业上用量最大的金属,在潮湿空气中易锈蚀,生成红棕色粉末状物质. | 单质遇淀粉溶液变蓝色. | 单质为双原子分子,常温下是液态,易溶于有机溶剂. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不同物质的量浓度硫酸等体积混合后,溶液物质的量浓度变为原来和的一半 |
| B、5.6 g铁与足量稀硫酸反应失去的电子的物质的量为0.3 mol |
| C、标准状况下,11.2L NO2气体中含氧原子数等于18 g水中含有的氧原子数 |
| D、20 g NaOH溶于1 L水,所得溶液中c(Na+)=0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Cl-的结构示意图: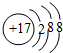 | ||
B、氯化氢分子的电子式: | ||
C、CH4Si的结构式: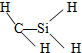 | ||
D、质量数为137的钡原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当7.8g Na2O2与H2O完全反应时,有0.2mol电子发生了转移 |
| B、将1.5molBr2通入2molFeI2溶液中的离子方程式3Br2+2I-+4Fe2+═2Br-+I2+2Fe3+ |
| C、用浓盐酸酸化KMnO4溶液以增强其氧化性 |
| D、在3NO2+H2O═2HNO3+NO中,氧化剂和还原剂的质量比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、灼烧灰化完成时,用坩埚钳把坩埚移至石棉网上 |
| B、用酒精萃取碘水中的碘 |
| C、用淀粉溶液检验碘的存在 |
| D、上层溶液从分液漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去N2中的少量O2:通过灼热的Cu粉,收集气体 |
| B、铅蓄电池在放电时,Pb作为负极,不断转化为PbSO4 |
| C、用盐酸酸化KMnO4溶液可以增强其氧化性 |
| D、强电解质在水中溶解度不一定大于弱电解质在水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | ||
| 起始物质的量 | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
| n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
| 含硫反应物的平衡转化率% | 80 | α1 | α2 | α3 | |
| A、乙中SO3的平衡转化率为α1=20% |
| B、平衡时,丙中c(SO3)是甲中的2倍 |
| C、平衡时,α3<α1 |
| D、该温度下,平衡常数的值为400 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有关M的下列叙述中正确的是( )
有关M的下列叙述中正确的是( )| A、可与H2反应,1 mol M最多消耗5 mol H2 |
| B、可与浓溴水反应,1 mol M最多消耗4 mol Br2 |
| C、可与NaOH溶液反应,1 mol M最多消耗3 mol NaOH |
| D、常温下,M在水中的溶解度小于苯酚在水中的溶解度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com