
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知煤液化过程中有反应CO(g)+2H2(g)=CH3OH(g),其反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
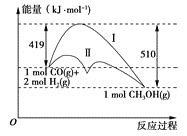
A.该反应的反应热ΔH=+91kJ·mol-1
B.加入催化剂后,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.从图中可以看出,使用催化剂降低了该反应的活化能
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.向1 L 1 mol·L-1 NaClO溶液中通入足量CO2,溶液中HClO的分子数为NA
B.标准状况下,体积均为2.24 L的CH4与H2O含有的电子总数均为NA
C.2 mol NO与1 mol O2在密闭容器中充分反应,产物的分子数为2NA
D.由13 g乙酸与2 g CO(NH2)2(尿素)形成的混合物中含有的氢原子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
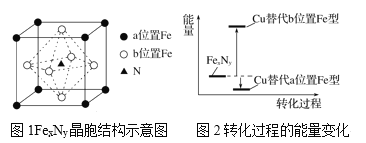
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)丙酮(CH3COCH3)分子中2号碳原子轨道的杂化类型是__,1mol丙酮分子中含有σ键的数目为___mol。
(2)C、H、O三种元素的电负性由小到大的顺序为__。(请填写元素名称,不要加任何连接符号)
(3)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关常温下0.1 mol/L氨水(pH=11)的说法正确的是
A.该氨水显弱碱性
B.加水稀释过程中,![]() 的值减小
的值减小
C.与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+)
D.加入少量NH4Cl 固体,溶液中水的电离平衡:H2O![]() H+ + OH―向右移动
H+ + OH―向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A. c(OH-)/c(NH3·H2O) B. n(OH-)
C. c(NH3·H2O)/c(OH-) D. c(H﹢)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中不正确的是( )
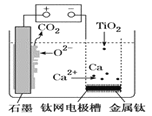
A.由TiO2制得1mol金属Ti,理论上外电路转移4mol电子
B.阳极的电极反应式为2O2--4e-=O2↑
C.在制备金属钛前后,整套装置中CaO的总量会不断减少
D.装置中石墨电极材料需要定期更换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们已经学习了几种典型的有机化学反应类型,写出下列反应的化学反应方程式,并判断其反应类型。
(1)由乙醇制乙烯_____属于_____反应。
(2)由苯制取硝基苯_____属于_____反应。
(3)由乙醇制乙醛_____属于_____反应。
(4)由丙烯腈(CH2=CH-CN)制备聚丙烯腈(人造羊毛的主要成分):_____,属于_____反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。某教师在指导学生做研究性学习时,拟利用废铁屑在实验室制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备补血剂硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O,相对分子质量为392]。硫酸亚铁铵晶体比一般亚铁盐稳定,在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)废铁屑的净化:将废铁屑投入10%的碳酸钠溶液中并加热5~10min,通过倾析法弃去纯碱溶液,并用蒸馏水洗净废铁屑,待用。
(2)酸浸净化后的废铁屑:将2gFe粉、10mL3mol·L-1的H2SO4溶液加入烧瓶中反应,用如图所示装置制备FeSO4溶液。保持温度70~80℃,适当添加水以补充被蒸发掉的水分,并控制溶液的pH,至反应无明显气泡产生,停止加热,过滤,称量残留固体质量。
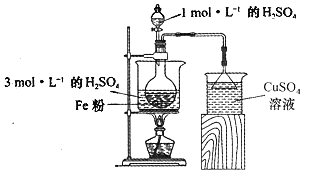
①反应过程中会产生少量H2S、PH3等气体,需使用封闭装置。写出用CuSO4溶液吸收H2S气体的化学反应方程式:____________________________
②反应过程中使用过量铁粉的目的是____________________________
(3)制备(NH4)2Fe(SO4)2·6H2O:向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。
实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是_____ (填序号)。
A.通入过量Cl2:Fe2+、H+、NH4+、Clˉ、SO42ˉ
B.加入过量KSCN溶液:K+、NH4+、Fe3+、SO42ˉ、SCNˉ
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42ˉ、OHˉ
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42ˉ、Clˉ、ClOˉ、OHˉ
(4)产品纯度测定:称取ag产品溶于水,配制成500mL溶液,取25.00mL待测液,用浓度为cmol·L-1的酸性KMnO4溶液滴定。重复上述操作2次实验结果如下:

该产品的纯度为____________________________(用含a、c的代数式表示)。
有同学提出,测定产品中SO42ˉ的含量也可测定产品的纯度,请补充完整实验方案:称取约0.4g样品,溶于70mL水,__________________________________________________,将沉淀移入坩埚,灼烧至恒重,记录数据(实验中必须使用的试剂有:2mol·L-1的HCl溶液、BaCl2溶液、AgNO3溶液)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com