
【题目】能正确表示下列反应离子方程式的是:
A.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
B.NaHCO3溶液中加入HCl:CO32-+2H+=CO2↑+H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
D.“84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:![]() +5Cl-+6H+=3Cl2↑+3H2O
+5Cl-+6H+=3Cl2↑+3H2O
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
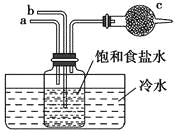
A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钒(VO2)是一种新型热敏材料。+4价的钒化合物在弱酸性条件下易被氧化。实验室以V2O5为原料合成用于制备VO2的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:

回答下列问题:
(1) VOC12中V的化合价为 ________。
(2)步骤i中生成VOC12的同时生成一种无色无污染的气体,该化学方程式为___。也可只用浓盐酸与V2O5来制备VOC12溶液,该法的缺点是 _______
(3)步骤ii可在下图装置中进行。

①反应前应通入CO2数分钟的目的是 ________。
②装置B中的试剂是____。
(4)测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。
称量ag样品于锥形瓶中,用20mL蒸馏水与30 mL混酸溶解后,加0.02 mol/LKMnO4溶液至稍过量,充分反应后继续加1 %NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,最后用c mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为b mL。滴定反应为:VO2++Fe2++2H+= VO2++Fe3++H2O.
①KMnO4溶液的作用是_______ 。NaNO2溶液的作用是______ 。
②粗产品中钒的质量分数的表达式为_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质的量的相关公式计算:
(1)16gO3和16g O2分子数之比为________,含氧原子数之比为________;
(2)12.7g FeCl2固体溶于水配成500mL溶液,其浓度为________molL-1,从该溶液中取出100mL溶液,其中C1-的浓度为________molL-1;
(3)某金属氯化物MCl227g,含有0.40 mol Cl-,则该氯化物的物质的量为________,M的摩尔质量为________。
(4)下列数量的各物质所含原子数按由大到小的顺序排列的是____________。
①34g氨气 ②标准状况下44.8L氦气 ③25°C时18 mL水 ④0.5 mol H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“暖冰”是科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。用“暖冰”做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液呈血红色。则下列说法不正确的是( )
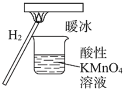
A.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧的产物中可能含有一定量的H2O2
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。

根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=_______________,升高温度,K值_______(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=_____________。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是_______:
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_______________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
A. 加入合金的质量不可能为6.4 g
B. 参加反应的硝酸的物质的量为0.1 mol
C. 沉淀完全时消耗NaOH溶液的体积为150 mL
D. 溶解合金时收集到NO气体的体积在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物c的制备原理如下:
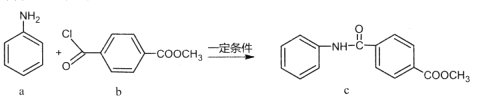
下列说法正确的是
A.该反应为加成反应B.化合物a中所有原子一定共平面
C.化合物C的一氯代物种类为5种D.化合物b、c均能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要作用。完成下列填空:
合成氨工业中:N2(g) + 3H2(g) ![]() 2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
(1)试比较K1、K2的大小,K1 ________K2(填写“>”、“=”或“<”)
(2) 400℃时,反应2NH3(g) ![]() N2(g) + 3H2(g)的化学平衡常数的值为_____________。
N2(g) + 3H2(g)的化学平衡常数的值为_____________。
当测得NH3和N2、H2的物质的量浓度分别为3 mol/L和2 mol/L、1 mol/L时,则该反应υ(N2)(正) ___________υ(N2)(逆)(填写“>”、“=”或“<”)
(3)在密闭恒容的容器中,下列能作为合成氨反应达到平衡的依据的是____________。
a.υ(N2)(正)=3υ (H2)(逆) b.混合气体的密度保持不变
c.容器内压强保持不变 d.N2、H2、NH3的浓度之比为1∶3∶2
(4)化工生产为做到又“快”又“多”采用多种方法,试写出两项合成氨工业中为实现“多”所采取的措施:__________________________,__________________________。
(5)0.1 mol/L的(NH4)2SO4水溶液中各离子浓度由大到小的顺序是_____________________,在该溶液中加入少量明矾固体,溶液中NH4+的浓度_______(填“增大”、“减小”或“不变”),其原因是_________________________________________________________。
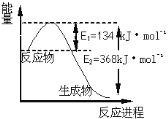
(6)如图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式 _____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com